創薬不可能(Undruggable)な疾患標的タンパク質を創薬可能(Druggable)にする技術!新しい創薬の概念を提案「温度ジャンプ」産学官金融連携

創薬不可能(Undruggable)な疾患標的タンパク質を創薬可能(Druggable)にする新技術、それが今回ご紹介する「温度ジャンプ」です。信州大学大学院総合理工学研究科(農学専攻)喜井勲教授、先鋭領域融合研究群バイオメディカル研究所 梅澤公二助教、大学院総合理工学研究科(農学専攻)修士課程 古家岳さんが提案する、創薬の新しい概念です。2021年3月に開催されたNEDO TCP 2020(※1)最終審査会において、NEDO認定ベンチャーキャピタルの投票によって選定される「認定VC賞」を受賞し、創薬関連企業との連携を積極的に進めています。(文・柳澤 愛由)
(※1)2021年3月9日開催、国立研究開発法人新エネルギー・産業技術総合(NEDO)主催「NEDO TCP(Technology Commercialization Program)2020」
・・・・・ 信州大学広報誌「信大NOW」第132号(2022.3.31発行)より
創薬の課題を解決する革新的な技術
病の多くは、体内にあるタンパク質の異常によって起こります。薬で病気が治るのは、薬に含まれる化合物が異常を来したタンパク質と結合し、その機能を阻害するからです。そのため創薬は、病気に関連するタンパク質=疾患標的タンパク質に結合する、薬の候補となる化合物を見つけ出すことから始まります。疾患標的タンパク質に化合物が結合するには、入り込むポケットのような隙間が不可欠。しかし、疾患標的タンパク質の中には、そもそも表面に起伏がなく化合物が結合できなかったり、特殊な構造を持っていたりするために、「創薬不可能=アンドラッガブル」とされているものが少なくありません。有効な薬のない病気が未だ数多くある理由のひとつです。
このような創薬の課題を解決する概念を、信州大学大学院総合理工学研究科(農学専攻)喜井勲教授らが見出しました。「試験管内ではアンドラッガブルな疾患標的タンパク質も、生きた細胞の中では『創薬可能=ドラッガブル』な状態になることがあると考えられます」と喜井教授は話します。今回ご紹介する特許技術「温度ジャンプ」は、「温度を上げる」というシンプルな方法で、試験管内で一時的に生きた細胞内と同じような環境を作り出し、「アンドラッガブル」とされていた疾患標的タンパク質を「ドラッガブル」に変える新しい創薬概念です。
細胞内でのタンパク質の状態を試験管の中で再現する
タンパク質はアミノ酸が多数つながったポリペプチド鎖がらせん状やシート状に連なった複雑な構造をしています。生きた細胞内では、ポリペプチド鎖がさらに複雑に折りたたまれて、立体的な構造をとっています。これまでの創薬研究では、この立体構造が完成したタンパク質を標的とするケースがほとんどでした。
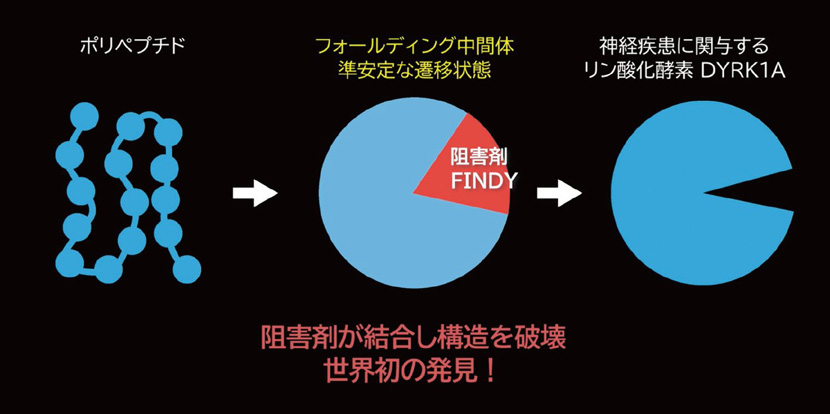
ここで喜井教授は、生きた細胞内ではタンパク質が立体構造を形成していく過程で、熱力学的な構造の“揺らぎ”が起きていることに注目しました。つまり、立体構造が揺らいだ準安定で過渡的な状態である「中間体」こそが、新たな創薬研究の突破口になると考えたのです。そこで、計算構造生物学を専門とする先鋭領域融合研究群バイオメディカル研究所 梅澤公二助教と連携し、中間体の揺らぎを可視化する分子構造のシミュレーションモデルを作り上げました。「ふらふらと揺らぎが起こると、ふとした瞬間に隙間やポケットが現れることがあります。これが、試験管内ではアンドラッガブルな疾患標的タンパク質でも、生きた細胞内であればドラッガブルになる理由です」と梅澤助教。
では、実際のスクリーニングでも生きた細胞を使えばいい―というと、決してそうではありません。生きた細胞を使う場合は、多大な手間とコストがかかり、とても現実的とはいえないからです。生きた細胞内の状態を試験管内で再現できれば、ドラッガブルとなる疾患標的タンパク質が増えるはず―そこで喜井教授らが確立した新技術が、「温度ジャンプ」です。
準安定な状態である 「中間体」に着目
「温度ジャンプ」は、疾患標的タンパク質と化合物を入れた試験管(マルチウェルプレート)を、一般的な分子生物学実験であるPCRに用いられる機器(サーマルサイクラー)に入れて温度を上げるだけです。しかしこれまで全く行われてこなかったのには、理由があります。そもそも、中間体を創薬標的とする研究は、世界を見渡してもほとんど例がありません。それは、準安定とはいえ、存在確率が低い中間体は、ほんのわずかな時間しか存在しないため、創薬の標的対象にならないと潜在的に考えられてきたからです。
しかし喜井教授らは、神経疾患に関与するタンパク質であるリン酸化酵素「DYRK1A(ダークワンエー)」の中間体にのみ選択的に結合する、「FINDY(フィンディ)」と名付けた化合物(阻害剤)を発見することに成功し、これまでの創薬研究の常識を覆したのです。事実、細胞内に一過的にしか存在しない中間体を標的とした阻害剤の発見は、世界初でした。
さらに研究を進める中で、「中間体を標的としてスクリーニングするからこその利点も見えてきました」と喜井教授。FINDYをより詳細に調べると、DYRK1A以外のリン酸化酵素には阻害活性を示さず、高い選択性を有していることも分かってきたのです。「高い選択性がある、ということは、標的タンパク質以外に対して作用しにくい、つまり副作用の少ない低分子医薬品の実現へとつながる可能性もあると考えています」(喜井教授)
今後、この技術を発展させ、創薬関連企業と連携して、新しい作用メカニズムに基づいた低分子医薬品の創出への道を拓きたいと言う喜井教授。膨大な時間と資金、労力を投資しても、創薬に成功する確率は極めて低い(※2)とされる中で、新しい創薬概念である「温度ジャンプ」による創薬成功確率の大きなジャンプ(=飛躍)が期待されます。
※2)日本製薬工業協会調べ