難治性がん治療薬に向けた新しい分子戦略の開発に成功 -細胞透過性中分子薬がK-Rasのたんぱく質間相互作用と脂質修飾を阻害する-
信州大学学術研究院(農学系)大神田 淳子 教授と、藤井 博 教授、南フロリダ大学 Jiazhi Sun教授、大阪大学産業科学研究所の加藤 修雄 教授、(株)医学生物学研究所 渡部 拓 博士らの共同研究グループは、難治性がん因子であるK-Rasたんぱく質の脂質翻訳後修飾 注1)を阻害する中分子薬の開発に成功しました。
Rasは、細胞の増殖など様々なシグナル伝達のスイッチとして重要な働きを担う重要なたんぱく質群です。Rasに変異が生じると細胞増殖が制御不能になり細胞ががん化します。こうしたRasの変異は約30%のがんで見出されることから、これまでRas標的薬が盛んに研究されてきました。しかしRasには薬剤分子が結合できるポケットが乏しいなどの理由から、未だ有効な臨床薬の開発には至っていません。
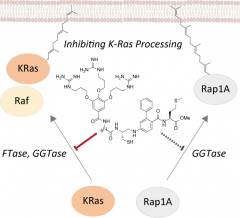
本研究では、複数のアイソフォームが存在するRasの中でも、難治性がんの肺がんやすい臓がんで9割以上の確率で変異が見出されるK-Rasたんぱく質に焦点を当て、K-Rasに直接結合する分子の代わりに、K-Rasの機能化に必須である脂質翻訳後修飾を阻害する分子を開発しました。具体的には、K-Rasの脂質修飾を担うファルネシル転移酵素とゲラニルゲラニル転移酵素に対し、両者の活性ポケットとともにK-Rasとのたんぱく質間相互作用作用面も同時に認識する部位を持つ中分子薬を設計し、より高い酵素結合親和性を持つように工夫しました。また従来の中分子薬の課題である低細胞透過性を改善させるために、細胞移行を促進するグアニジル基と疑似ペプチドを導入しました。in vitro実験の結果、化合物が従来の酵素阻害剤を遥かに上回る酵素阻害活性を示すことが明らかとなり、たんぱく質間相互作用作用面への結合が効果的に活性向上に寄与していることが示唆されました。また、細胞イメージング実験の結果、合成した中分子薬がK-Rasの脂質修飾と細胞膜への局在化を阻害し、その結果、信号伝達系下流の結合因子c-Rafとの相互作用が抑制され、細胞増殖が顕著に抑制されることが明らかになりました。本研究は、中分子薬がこれまで困難であったK-Ras脂質修飾の制御ができることを示した初めての例であり、難治性がんに対する新しい創薬戦略として期待されます。
本論文はChemistry -A European Journalの"Hot Paper"(注目論文)に選ばれるとともに、表紙にも選出されました。
https://doi.org/10.1002/chem.201903846
注1)タンパク質が生合成(翻訳)された後に受ける種々の修飾のこと。リン酸化、メチル化、脂質修飾、糖鎖付加などがある。タンパク質の活性化や安定化、局在にこれらの修飾が関わっている。Rasは脂質が付加されることで細胞膜に移行できるようになる。
図の解説:K-Rasはタンパク質として合成された後に、脂質修飾されることでシグナル伝達が可能になります。この脂質の結合には2つの酵素(FTaseとGGTase)が関係することが分かっており、今回、著者らは、FTaseとGGTaseのK-Rasへの結合を、1つの化合物で阻害することに成功しました。その結果、脂質が付加されたK-Rasの結合相手の1つであるc-Rafとの結合も阻害されました。さらに、この化合物は、K-Rasと構造的、機能的に非常に高い類似性を持つタンパク質であるRap-1AとGGTaseの結合を阻害しなかったことから、K-Rasに対する特異性を示すことが分かりました。