悪性黒色腫患者を対象としたインターロイキン12発現型遺伝子組換え単純ヘルペスウイルス1型の第Ⅰ/Ⅱ相臨床試験の概要(医療専門家向け)
ウイルス療法とは
ウイルスを腫瘍細胞に感染させ、ウイルスの直接的な殺細胞作用により腫瘍の治癒を図る治療法である。腫瘍細胞特異的なウイルス複製が得られるようにウイルスゲノムに人為的な変異を加える。遺伝子組換えウイルスは、腫瘍細胞に感染すると複製し、その過程で宿主となった腫瘍細胞は死滅する。増えたウイルスは拡散して周囲の腫瘍細胞に感染し、ウイルス複製→細胞死→感染を繰り返して腫瘍細胞を破壊する。正常細胞ではウイルス複製ができないため、正常組織は傷害しない。
T-hIL12とは
- 三重変異を有する第三世代の遺伝子組換えヒト単純ヘルペスウイルス1型(HSV−1)
- 東京大学で膠芽腫を対象に医師主導治験Ⅱ相が行われ、安全性とともに有効性が示された第三世代HSV-1(G47Δ)の改良型
- ヒトIL-12が組込まれており、腫瘍細胞の中で複製する際にIL-12が発現するので効率的に腫瘍免疫を惹起する
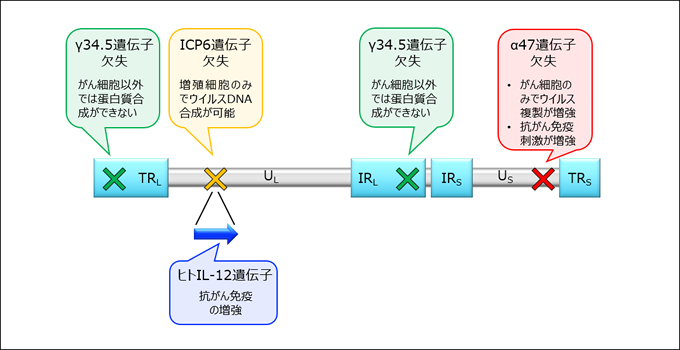 T-hIL12のDNA構造:三重変異とIL-12の組込み
T-hIL12のDNA構造:三重変異とIL-12の組込み
臨床試験の概要
| 目的: |
【第Ⅰ相】進行期の悪性黒色腫患者を対象として、ヒトIL-12発現型遺伝子組換え単純ヘルペスウイルス1型T-hIL12の安全性を評価する。
【第Ⅱ相】進行期の悪性黒色腫患者を対象として、標準治療に上乗せする際の、T-hIL12の安全性及び有効性を検討する。 |
| 試験デザイン: |
対照群のないオープンラベル試験(第Ⅰ/Ⅱ相試験) |
| 対象疾患: |
【第Ⅰ相】標準治療である、免疫チェックポイント阻害薬(抗CTLA-4抗体、抗PD-1抗体)あるいは分子標的薬(BRAF阻害薬の単独療法又はBRAF/MEK阻害薬の併用療法)の治療歴があり、進行により現時点でいずれの標準治療も実施が適切でない、あるいは適応がないと判断される悪性黒色腫患者。
【第Ⅱ相】標準治療のニボルマブをファーストラインの全身療法として投与する悪性黒色腫患者。 |
| 投与方法: |
腫瘍内投与。1回あたりのT-hIL12の投与総量は3 × 108pfuとし、投与間隔は2週間(〜4週間まで可)とする。
【第Ⅰ相】投与回数は第1コホートでは2回、第2コホートでは4回。
【第Ⅱ相】第Ⅰ相で決定した回数(2回又は4回)。 |
| 評価項目: |
【第Ⅰ相】安全性の評価、奏効率、全生存期間、無増悪生存期間、腫瘍縮小効果
【第Ⅱ相】奏効率、安全性の評価、全生存期間、無増悪生存期間、腫瘍縮小効果 |
| 評価期間: |
最終回投与後24週間 |
| 募集予定期間: |
2019年7月〜 |
| 被験者数: |
【第Ⅰ相】 6名
【第Ⅱ相】 18名 |
| 実施医療機関: |
信州大学医学部附属病院皮膚科、東京大学医科学研究所附属病院脳腫瘍外科 |
*現在、第Ⅱ相試験に参加される患者を募集しています(第Ⅰ相試験は終了しました)。
選択基準の詳細情報
適格基準
第Ⅱ相
切除不能又は転移性悪性黒色腫患者で、以下の基準をすべて満たす患者
- 組織学的に診断が確定し、皮膚悪性黒色腫のAJCC (American Joint Committee on Cancer) 8版に基づく臨床病期がⅢ又はⅣに相当する。
- 最長径10mm以上の注入可能な皮膚・皮下の悪性黒色腫病変、又は短軸15mm以上の注入可能な転移リンパ節病変が1つ以上認められる。
- 標準治療のニボルマブをファーストラインの全身療法として投与する患者(術後のadjuvant therapyとしてダカルバジン、インターフェロン等を投与された患者を含む)。
- 理学的所見及び画像検査で全身の転移巣の分布と大きさが把握されている。
- 同意取得時の年齢が20歳以上(性別は不問)。
- 前治療が終了してから30日以上が経過している。
- Eastern Cooperative Oncology GroupのPerformance Statusが0~1。
- 治験薬投与開始前28日以内の血液検査の結果が以下をすべて満たす。
- 骨髄機能:白血球数2,000/mm3以上、好中球数1,000/mm3以上、血小板数100,000/mm3以上、ヘモグロビン9.0 g/dL以上、プロトロンビン時間の国際標準比(PT-INR)施設基準値の1.3倍以内
- 肝機能:AST及びALTが施設基準値上限の4倍以下、総ビリルビン2.5 mg/dL以下、直接ビリルビン1.5 mg/dL以下
- 腎機能:クレアチニン1.7 mg/dL以下
除外基準
第Ⅱ相
たとえ選択基準を満たしても、以下のいずれかに抵触する患者は本試験の対象から除外する。
- 脳又は中枢神経に転移が認められる患者
- 予測される生存期間が6ヶ月未満の患者
- 妊娠中又は授乳中の女性
- 治験薬投与開始から投与終了後6ヶ月までバリア型避妊を実行する意思がない患者
- 緊急治療を要する胸水、腹水、心嚢液貯留がある患者
- 活動性の感染症を合併している患者
- 無病期間が5年未満の重複癌を有する患者(適切に治療された上皮内癌・皮膚の表皮内癌・基底細胞癌を有する患者は対象としてよい)
- ヒト免疫不全症ウイルス(HIV)の検査結果が陽性の患者又は過去に検査結果が陽性であった患者
- 活動性のヘルペスウイルス感染を有する患者
- アシクロビル、バラシクロビルなどの抗ヘルペスウイルス薬に対するアレルギー反応の既往がある患者
- プレドニゾロン換算で10 mgを超えるステロイド又は免疫抑制薬が投与されている患者
- 他の治験薬(又は研究的治療)の投与をT-hIL12投与開始前30日(又は他の治験薬等の消失半減期の5倍のいずれか長い期間)以内に受けた患者
- がん治療用ウイルスの投与を受けた患者
- その他、治験責任医師又は治験分担医師(担当医師)が不適格と判断した患者
*第Ⅱ相試験では、標準治療のニボルマブをファーストラインとして投与する悪性黒色腫患者を対象とします。
