当部門では、哺乳類の心筋や骨格筋の収縮メカニズムについて、個体から分子レベルまで多角的に研究を行っています。最近は特に、筋収縮に重要な役割を果たすカルシウムイオン代謝について、疾患の際にどのような変化があるかを調べています。
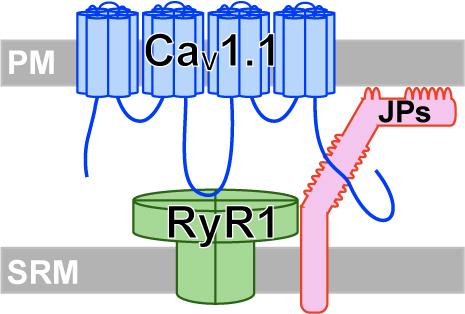
テーマ1.骨格筋の収縮におけるL型カルシウムチャネルとジャンクトフィリンの役割
- L型カルシウムチャネル(LTCC)は,骨格筋の収縮に必要不可欠な存在です。LTCCは細胞膜の電位変化を関知し,立体構造を変化させることで,物理的に結合している筋小胞体膜上のリアノジン受容体を開口させます。これにより,筋小胞体から大量のカルシウムイオンが放出され,筋細胞が収縮します。このプロセスを効率的に起こすために,骨格筋のLTCCは表面細胞膜と筋小胞体膜が近接する結合膜構造と呼ばれる部位に特異的に局在しています。LTCCの結合膜への局在は筋の正常な興奮収縮連関に必須ですが,その集積メカニズムの詳細はわかっていません。私たちはジャンクトフィリン(JP)と呼ばれる分子に注目し,このLTCCの結合膜構造への集積機構について解析を行いました。JPは表面細胞膜と筋小胞体膜を物理的に橋渡しし,結合膜構造を維持するタンパク質として知られています。
- はじめに,培養細胞由来の筋管のJPの発現をRNA干渉により抑制すると,LTCCの結合膜への局在化が阻害され,カルシウム放出の減少などの機能異常が認められました。さらに詳細な解析を行った結果,LTCCの主要サブユニットタンパク質であるCaV1.1が,JPと物理的に結合していることが分かりました。
- 次に,JPのC末端欠失変異体(JP1ΔCT)を作製しました。この変異体は筋小胞体膜貫通部位を持たないため,結合膜に集積せず,細胞膜全体に分布するようになります。これを筋管に強制発現すると,LTCCの結合膜への集積が抑制されました。この結果は,JP1ΔCTがLTCCの正常な細胞内局在を阻害する,ドミンナントネガティブ様の作用を持つことを示しています。そこで,アデノ随伴ウイルスベクターを用いて,JP1ΔCTをマウス筋にin vivoで発現させる実験を行いました。その結果,JP1ΔCTを発現させた筋肉では,LTCCと内在性のJPの結合が阻害され,リアノジン受容体との結合も減少していました。これは骨格筋のLTCCの結合膜への集積に,JPとの結合が重要であることを示しています。また,生理学的な解析では,電気刺激に対するカルシウム応答や,筋の収縮力などが有意に減少していました。以上の結果から,LTCCのCaV1.1とJPとの物理的結合が,正常な筋収縮にとって必要であることが示唆されました。(Nakada et al., Proc Natl Acad Sci U S A. 2018 115: 4507-4512)
テーマ2.L型Ca2+チャネルのクラスタリング機構に関する研究
- 心筋のL型Ca2+チャネルとリアノジン受容体は,形質膜・筋小胞体接合部でクラスタリングし,機能的複合体を形成しています(図1)。L型Ca2+チャネルの接合部への局在は,心室筋の迅速で効率的な興奮収縮連関に不可欠ですが,その局在を決定する機構は明らかになっていません。この機構を明らかにするために,骨格筋芽細胞株GLTをモデルとして用いた研究を行っています。GLTは骨格筋L型Ca2+チャネルのα1Sサブユニットを先天的に欠損したマウスから樹立された細胞株です。この細胞にα1Sサブユニットを強制発現させると,リアノジン受容体とのクラスタリングが観察出来ます。また,心筋L型Ca2+チャネルのα1Cサブユニットを発現させても,同様にクラスターを形成することが明らかになっています(図2)。最近私たちは,心筋L型Ca2+チャネルがリアノジン受容体とクラスターを形成するためには,チャネルを構成するα1CサブユニットのC末端の近位側のアミノ酸配列が必要であることを明らかにしました(Nakada, T. et al. (2012) Biochem. J. 448: 221-231)。この機構をさらに詳細に解析することで,心筋や骨格筋の興奮収縮連関の分子基盤を明らかにできると考えています。
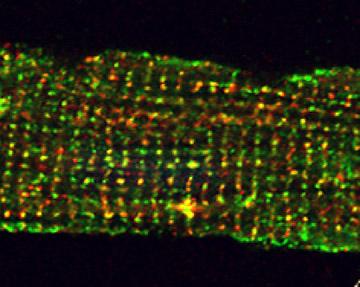
- 図1:心筋細胞のL型Ca2+チャネルとリアノジン受容体は形質膜・筋小胞体接合部で共局在している。L型Ca2+チャネルのα1Cサブユニット(緑),リアノジン受容体(赤)。
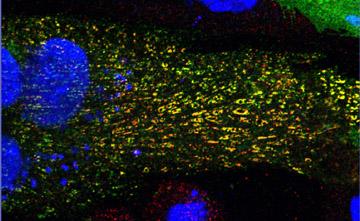
- 図2:GLT細胞に心筋L型Ca2+チャネルのαサブユニットを強制発現させると,共局在しクラスターを形成する。α1Cサブユニット(緑),リアノジン受容体(赤),核(青)。