分子医化学
概要
教育分野:分子生物学、医化学、病態医化学
研究分野:癌炎症(現象から、関与分子を特定する)
教室員は、医学、理学、工学部のバックグラウンドを持つスタッフから構成され、網羅範囲は広いです。癌の治癒を目指し、哺乳類(マウスーヒト)の癌の発生、増殖、転移の研究に焦点を当てています。特に癌が生着する土壌(癌が育ったり、転移が起きたりする、体の臓器の環境)のメカニズムを解明するため、原因・関連する分子を探して、その制御を目指しています。
研究テーマ
-癌の転移の前の組織の様子とは?
<なぜ研究するのか?>
癌が転移する前の時点で、離れた他の臓器の局所に、転移するのに有利な“転移予定地”を形成することを、マウスを用いた研究で明らかにしてきました。しかし、癌の転移がなぜ臓器の特定の局所におきるのかは分かっていません。さらに、そのような“転移予定地”が形成される現象が“人”においてもあるのか、確かめられていませんでした。
<研究で明らかになってきたこと>
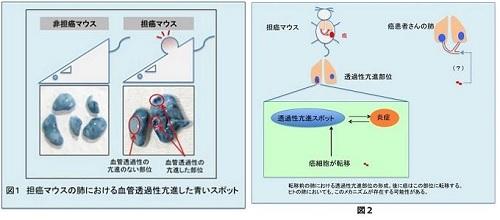
担癌マウス(皮下や乳腺組織などに癌を実験的に移植したマウス)に青色の色素を静脈内投与すると、局所の血管から青色色素が漏れ出す現象(血管透過性の上昇)が起き、転移前の肺の局所に濃い青色のスポットが形成され(図1)、そこに転移が起こります。この現象の分子メカニズムを調べる為、色素の漏出が多い部分と少ない部分からRNAを抽出して網羅的に遺伝子発現を比較しました。その結果から発現に差のある遺伝子の中で、血管透過性の上昇による炎症様反応に関係すると考えられる、自然免疫で中心的な役割を果たしている分子群に着目しました。この分子群の遺伝子欠損マウスの担癌マウスでは、血管透過性の高い部位は殆ど見られませんでした。次に、遺伝子の正常な野生型の担癌マウスに、癌細胞を静脈から入れると、肺の血管透過性が上昇している局所に一致した癌細胞の集まりが観察されますが、遺伝子欠損担癌マウスではそれが認められず、癌の転移も抑制されました。他方、転移を伴う癌で亡くなった患者さんの転移のない部分に、担癌マウスでみられた“転移予定地”と大変良く似た炎症性反応が起きている可能性を見出しました(図2)。最近マウスにおけるこの転移予定地にナチュラルキラー細胞様の抗転移細胞が存在することを発見し、それが細胞外核酸により制御されるという新規概念のもと、がんの転移を抑制することを見出しました(成果1)。人における癌転移の予測や予防的な治療につながることが期待され、さらに研究を進めています。
スタッフ
| 教授 | 平塚 佐千枝 |
|---|---|
| 准教授 | 富田 毅 |
| 助教 | 加藤 真良 |
学生数
| 博士課程学生数 | 1名 |
|---|
研究室の所在及び連絡先
メールアドレス:hira(at)shinshu-u.ac.jp
主要な成果/Major Publications
- Tomita T, Kato M, Mishima T, Matsunaga Y, Sanjo H, Ito KI, Minagawa K, Matsui T, Oikawa H, Takahashi S, Takao T, Iwai N, Mino T, Takeuchi O, Maru Y, Hiratsuka S.(2021) Extracellular mRNA transported to the nucleus exerts translation-independent function Nat. Commun. 12(1):3655. doi: 10.1038/s41467-021-23969-1.
- Hiratsuka S., Tomita T., Mishima T., Matsunaga Y., Omori T., Ishibashi S., Yamaguchi S., Hosogane T., Watarai H., Omori-Miyake M., Yamamoto T., Shibata N., Watanabe A., Aburatani H., Tomura M., High. KA., Maru Y. (2018) Hepato-entrained B220+CD11c+NK1.1+ cells regulate pre-metastatic niche formation in the lung. EMBO Mol. Med. e8643, doi: 10.15252/emmm.201708643
- Hiratsuka S., Ishibashi S., Tomita T., Watanabe A., Akashi-Takamura S., Murakami M., Kijima H., Miyake K., Aburatani H., Maru Y. (2013) Primary tumours modulate innate immune signalling to create pre-metastatic vascular hyperpermeability foci. Nature Communications 4: Article number: 1853 doi:10.1038/ncomms2856.
- Hiratsuka S, Goel S, Kamoun WS, Maru Y, Fukumura D, Duda DG, Jain RK. (2011) Endothelial focal adhesion kinase mediates cancer cell homing to discrete regions of the lungs via E-selectin up-regulation. Proc Natl Acad Sci U S A. 108: 3725-3730.
- Hiratsuka S, Duda DG, Huang Y, Goel S, Sugiyama T, Nagasawa T, Fukumura D, Jain RK. (2011) C-X-C receptor type 4 promotes metastasis by activating p38 mitogen-activated protein kinase in myeloid differentiation antigen (Gr-1)-positive cells. Proc Natl Acad Sci U S A. 108: 302-307.
- Hiratsuka S, Watanabe A, Sakurai Y, Akashi-Takamura S, Ishibashi S, Miyake K, Shibuya M, Akira S, Aburatani H, Maru Y. (2008) The S100A8-serum amyloid A3-TLR4 paracrine cascade establishes a pre-metastatic phase. Nat. Cell Biol. 10: 1349-1355.
- Hiratsuka S, Watanabe A, Aburatani H, Maru Y. (2006) Tumor-mediated upregulation of chemoattractants and recruitment of myeloid cells pre-determines lung metastasis. Nat. Cell Biol. 8: 1369-1375.
- Hiratsuka S, Nakamura K, Iwai S, Murakami M, Itoh T, Kijima H, Shipley JM, Senior RM, Shibuya M. (2002) Involvement of MMP9 induction by Vascular Endothelial Growth Factor Receptor-1 in lung specific metastasis. Cancer Cell 2 : 289-300.
(転移前土壌を発見した最初の論文)