がん免疫療法は、殺細胞機序が異なる、特異性が高い、副作用が少ないなどの利点から、手術、薬物治療、放射線治療に次ぐ第4のがん治療法として以前から期待されてきました。しかし、長年その臨床効果について疑問視されてきました。転機となったのは、抗PD-1、PD-L1抗体をはじめとする免疫チェックポイント阻害剤の有用性が報告されてからで、現在ではがん免疫療法が第4のがん治療法として認識されるようになりました。ただし、免疫チェックポイント阻害剤の奏効率は20-30%程度と十分ではありません。
キメラ抗原受容体(CAR)T細胞は、最も有望な次世代がん治療薬の1つで、2019年にリンパ系腫瘍に対するCD19.CAR-T細胞療法が本邦でも承認されました。
<CAR-T細胞の構造>
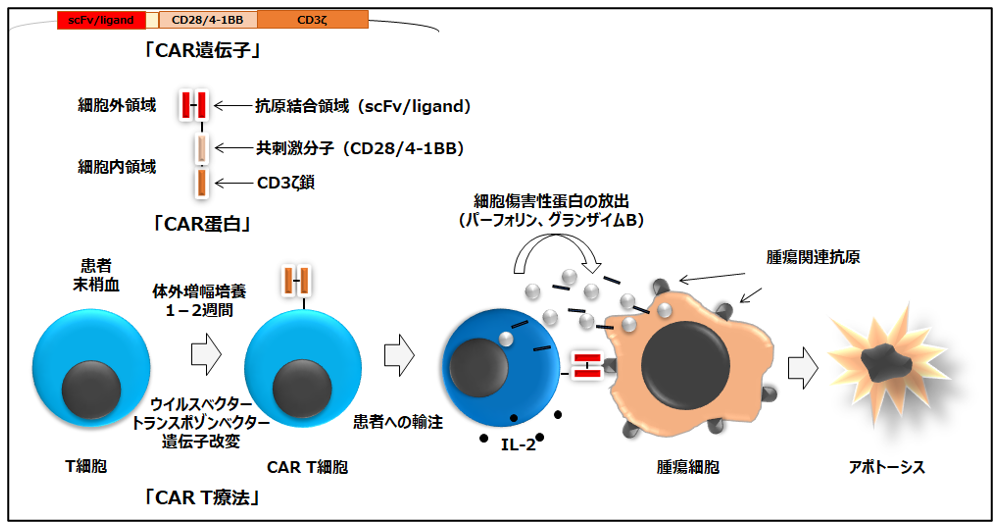
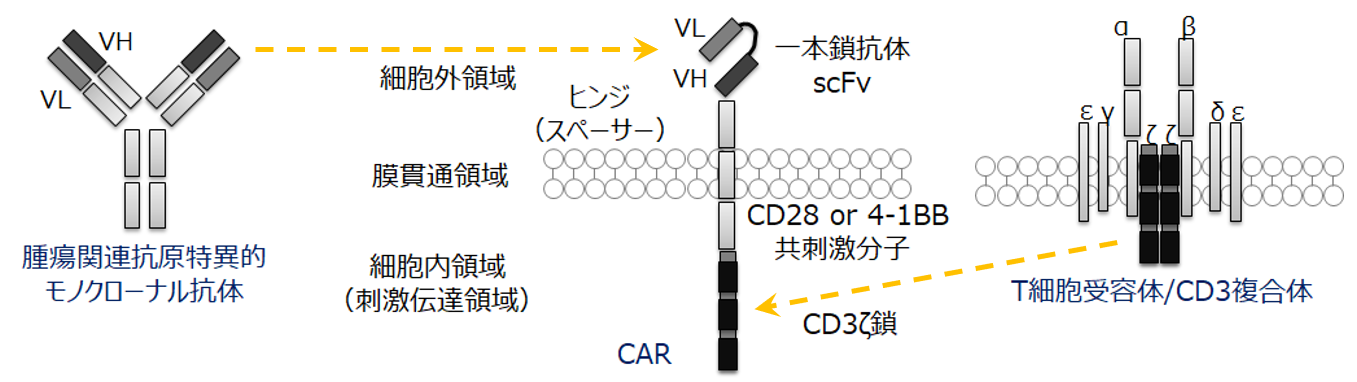
<CAR-T細胞療法の特徴>
・抗原特異性が高い
・抗原親和性・結合性が高い
・細胞傷害活性が高い
・免疫原性や免疫寛容に左右されない
・糖鎖・糖脂質も標的
・体内で増幅・長期間維持される
・血液脳関門を通過できる
・HLA非拘束性
<CAR-T細胞療法の課題>
・効果の持続
*標的抗原の消失
*CAR-T細胞の消失・疲弊
・安全性
*サイトカイン放出症候群
*中枢神経毒性
*On-target/off-tumor副作用
*off-target副作用
・コスト
*複雑な特許
*厳しいレギュレーション
*テーラーメード製造
*危険なfirst-in-human試験
*莫大な開発費用
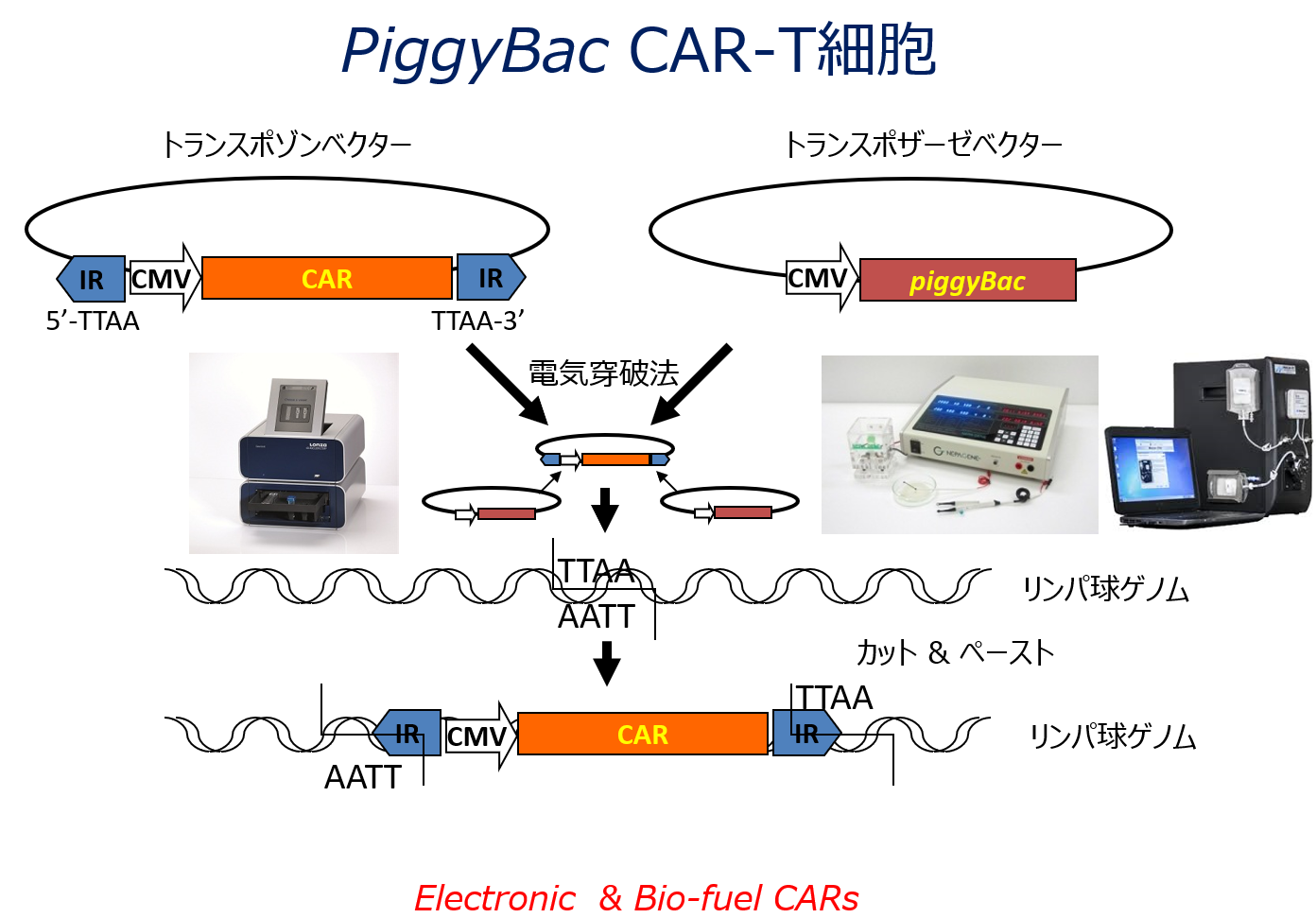
<非ウイルス遺伝子改変法によるCAR-T細胞の作製>
CAR-T細胞作製には、ウイルス遺伝子改変法(レトロウイルスやレンチウイルス)が世界の主流です。一方、以下のようなデメリットがあります。
・ラージスケール細胞培養設備が必要となるため、臨床試験が高額となり、患者投与に至るまでの期間が長い
・複製能力を有するウイルスや偶発性物質の混入の危険性
・ウイルスの混入を否定するための生物学的安全検査が膨大で高額
・がん原遺伝子への挿入変異の頻度が高い
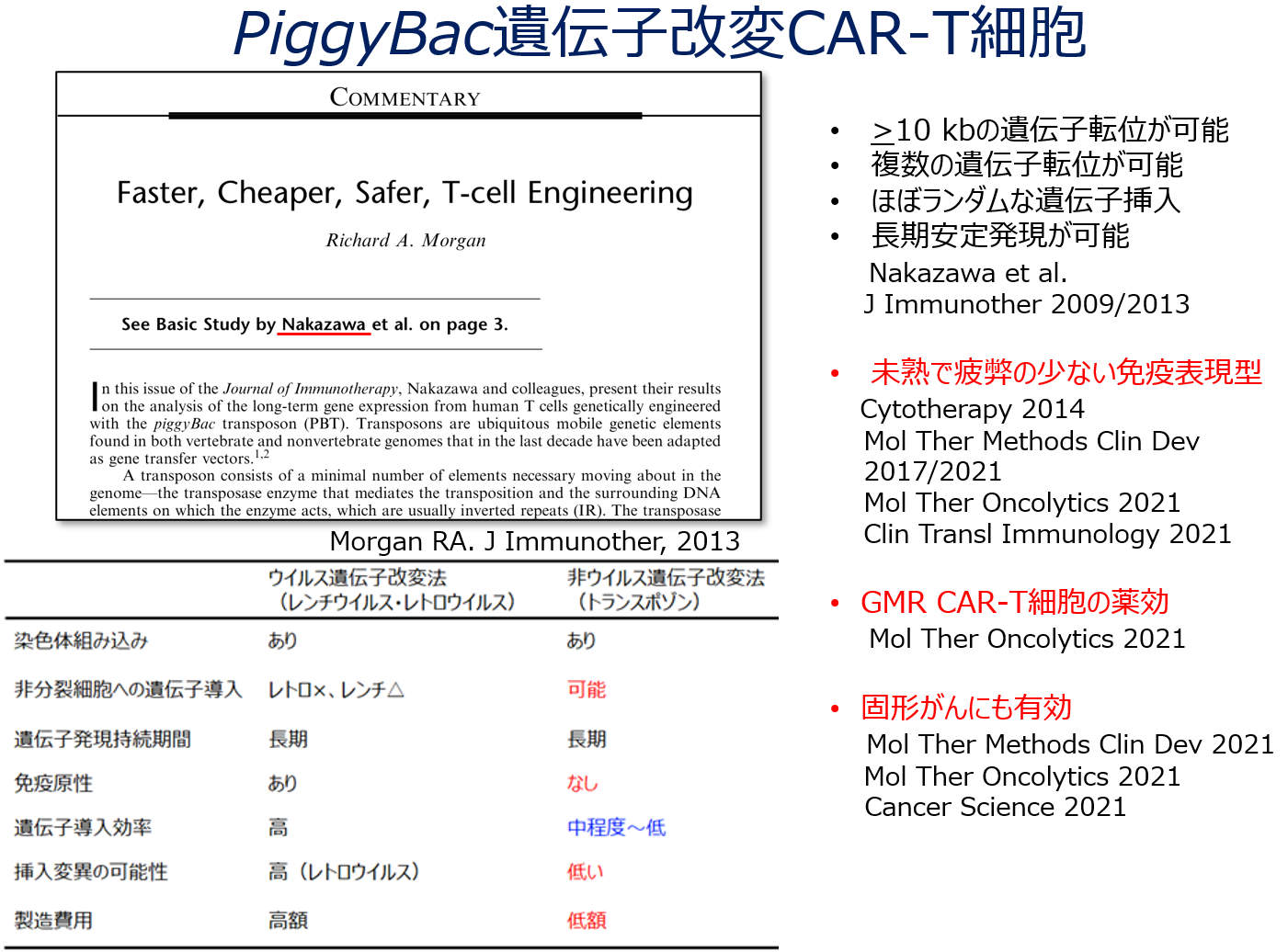
信州大学小児科では、当科の中沢教授が開発した非ウイルス遺伝子改変技術であるpiggyBacトランスポゾン法(酵素触媒遺伝子転位法)をCAR-T作製に用いることにより、ウイルス遺伝子改変法のデメリットを克服することに成功しました。piggyBacトランスポゾン法は、ウイルスベクターを用いる遺伝子導入療法に比べ、格段にコストが低く、癌原遺伝子への親和性も低いことから、臨床応用に向けたハードルが低いと考えられます。すでに本法を用いた第一相臨床試験がCD19.CAR-Tで開始されています(CD19陽性急性リンパ性白血病に対するpiggyBacトランスポゾン法によるキメラ抗原受容体遺伝子改変自己T細胞の安全性に関する臨床第Ⅰ相試験, UMIN000030984)。
*PiggyBac遺伝子改変技術によるCAR-T細胞の作製*
*PiggyBac遺伝子改変技術によるCAR-T細胞の作製の利点*
<骨髄性白血病に対する新規CAR-T細胞療法の開発>
我々は、世界で初めてGM-CSF受容体を標的とした骨髄性白血病に対する新規CAR-T細胞を開発しました(GMR.CAR-T)。GMR.CAR-Tは下記のような特徴のある画期的なCAR-T細胞です。
・日本で初めてリガンド型CARをデザイン
・世界で初めて若年性骨髄単球性白血病(JMML)を対象
・日本で初めて急性骨髄性白血病(AML)を対象
・AMED革新的がん医療実用化研究事業によるアカデミア創薬
*CD116陽性骨髄系腫瘍を標的とした非ウイルス遺伝子改変キメラ抗原受容体T細胞の非臨床試験
(H29-R1年度 中沢班)
*CD116陽性急性骨髄性白血病および若年性骨髄単球性白血病を対象とする非ウイルス遺伝子改変
GMR CAR-T細胞のFIH医師主導治験(R2-R4年度 中沢班)
☆GMR CAR-T細胞を用いた医師主導治験に関する詳細は次のリンクをご覧ください。
https://www.amed.go.jp/news/seika/kenkyu/20210407.html
☆GMR CAR-T細胞を用いた医師主導治験に参加を希望される方(患者様・主治医)は、次のメールアドレスにご連絡ください。gmr_cart-cr@shinshu-u.ac.jp
<固形腫瘍に対する新規CAR-T細胞療法の開発>
受容体を標的とするリガンド型の新規CAR-Tを中心に研究開発しています。また、HER2陽性腫瘍に対するHER2 CAR-Tの開発をブライトパス・バイオ株式会社と共同で行っています。また、軟部肉腫に対するEPHB4 CAR-Tの共同研究を京都府立医科大学小児科柳生茂希先生と行っています。難治性がんと闘う子どもたちの未来をつくる(2020年度 信州のファーストペンギン)
☆キムリア(チサゲンレクルユーセル)
①25歳以下の再発又は難治性のCD19陽性のB細胞性急性リンパ芽球性白血病と②再発又は難治性のびまん性大細胞型B細胞リンパ腫に対して、保険診療として実施しています。当院でのキムリア治療をご検討されている方は、信州大学医学部附属病院 先端細胞治療センター(0263-37-3220)までお問い合わせください。
☆GMR CAR-T細胞を用いた医師主導治験
急性骨髄性白血病および若年性骨髄単球性白血病(CD116陽性骨髄系腫瘍)の患者を対象として、GMR CAR-T細胞療法の安全性と有効性の評価を目的とした第I/II相医師主導治験(ヒト初回投与試験)を実施中です。当院でのGMR CAR-T細胞療法の治験参加をご検討されている方は、次のメールアドレスにご連絡ください。
gmr_cart-cr@shinshu-u.ac.jp
信州大学発!次世代のがん治療とは(2021年7月15日 abnステーション「コレイマ」)
2021年
1.Tomida A, Yagyu S, Nakamura K, Kubo H, Yamashima K, Nakazawa Y, Hosoi H, Iehara T, Inhibition of MEK pathway enhances the antitumor efficacy of chimeric antigen receptor T cells against neuroblastoma. Cancer Science. 2021 in press.
2.Yagyu S, Mochizuki H, Yamashima K, Kubo H, Saito S, Tanaka M, Sakamoto K, Shimoi A, Nakazawa Y. Lymphodepleted non-human primate model for the assessment of acute on-target and off-tumor toxicity of human CAR-T cells. Clin Transl Immunology. 2021;10(6):e1291.
3.Hasegawa A, Saito S, Narimatsu S, Nakano S, Nagai M, Ohnota H, Inada Y, Morokawa H, Nakashima I, Morita D, Ide Y, Matsuda K, Tashiro H, Yagyu S, Tanaka M, Nakazawa Y. Mutated GM-CSF-based CAR T-cells targeting CD116/CD131 complexes exhibit enhanced anti-tumor effects against acute myeloid leukemia. Clin Transl Immunology. 2021;10(5):e1282.
4.Nakamura K, Yagyu S, Hirota S, Tomida A, Kondo M, Shigeura T, Hasegawa A, Tanaka M, Nakazawa Y. Autologous antigen-presenting cells efficiently expand piggyBac transposon CAR-T cells with predominant memory phenotype. Mol Ther Methods Clin Dev. 2021;21:315-324.
5.Kubo H, Yagyu S, Nakamura K, Yamashima K, Tomida A, Kikuchi K, Iehara T, Nakazawa Y, Hosoi H. Development of non-viral, ligand-dependent, EPHB4-specific chimeric antigen receptor T cells for treatment of rhabdomyosarcoma. Mol Ther Oncolytics. 2021;20:646-658.
2020年
1.Morokawa H, Yagyu S, Hasegawa A, Tanaka M, Saito S, Mochizuki H, Sakamoto K, Shimoi A, Nakazawa Y. Autologous non-human primate model for safety assessment of piggyBac transposon-mediated chimeric antigen receptor T cells on granulocyte-macrophage colony-stimulating factor receptor. Clin Transl Immunology. 2020;9(11):e1207
2.Tanaka K, Kato I, Tanaka M, Morita D, Matsuda K, Takahashi Y, Nakahata T, Umeda K, Hiramatsu H, Adachi S, Takita J, Nakazawa Y. Direct delivery of piggyBac CD19 CAR T cells has potent anti-tumor activity against ALL cells in CNS in a xenograft mouse model. Mol Ther Oncolytics. 2020 26;18:37-46.
3.Sun C, Shou P, Du H, Hirabayashi K, Chen Y, Herring LE, Ahn S, Xu Y, Suzuki K, Li G, Tsahouridis O, Su L, Savoldo B, Dotti G. THEMIS-SHP1 Recruitment by 4-1BB Tunes LCK-Mediated Priming of Chimeric Antigen Receptor-Redirected T Cells. Cancer Cell. 2020;37(2):216-225.
2019年
1.Krokhotin A, Du H, Hirabayashi K, Popov K, Kurokawa T, Wan X, Ferrone S, Dotti G, Dokholyan NV. Computationally Guided Design of Single-Chain Variable Fragment Improves Specificity of Chimeric Antigen Receptors. Mol Ther Oncolytics. 2019 Aug 31;15:30-37.
2.Ahn S, Li J, Sun C, Gao K, Hirabayashi K, Li H, Savoldo B, Liu R, Dotti G. Cancer Immunotherapy with T Cells Carrying Bispecific Receptors That Mimic Antibodies. Cancer Immunol Res. 2019;7(5):773-783.
3.Du H, Hirabayashi K, Ahn S, Kren NP, Montgomery SA, Wang X, Tiruthani K, Mirlekar B, Michaud D, Greene K, Herrera SG, Xu Y, Sun C, Chen Y, Ma X, Ferrone CR, Pylayeva-Gupta Y, Yeh JJ, Liu R, Savoldo B, Ferrone S, Dotti G. Antitumor Responses in the Absence of Toxicity in Solid Tumors by Targeting B7-H3 via Chimeric Antigen Receptor T Cells. Cancer Cell. 2019;35:221-237.
2018年
1.Hamada M, Nishio N, Okuno Y, Suzuki S, Kawashima N, Muramatsu H, Tsubota S, Wilson MH, Morita D, Kataoka S, Ichikawa D, Murakami N, Taniguchi R, Suzuki K, Kojima D, Sekiya Y, Nishikawa E, Narita A, Hama A, Kojima S, Nakazawa Y, Takahashi Y. Integration Mapping of piggyBac-Mediated CD19 Chimeric Antigen Receptor T Cells Analyzed by Novel Tagmentation-Assisted PCR. EBioMedicine. 2018;34:18-26.
2.Bilal Omer, Paul A Castillo, Haruko Tashiro, Thomas Shum, Mai T A Huynh, Mara Cardenas, Miyuki Tanaka, Andrew Lewis, Tim Sauer, Robin Parihar, Natalia Lapteva, Michael Schmueck-Henneresse, Malini Mukherjee, Stephen Gottschalk, Cliona M Rooney. Chimeric Antigen Receptor Signaling Domains Differentially Regulate Proliferation and Native T Cell Receptor Function in Virus-Specific T Cells. Front Med (Lausanne). 2018;5:343.
2017年
1.Morita D, Nishio N, Saito S, Tanaka M, Kawashima N, Okuno Y, Suzuki S, Matsuda K, Maeda Y, Wilson MH, Dotti G, Rooney CM, Takahashi Y, Nakazawa Y. Enhanced expression of anti-CD19 chimeric antigen receptor in piggyBac transposon-engineered T cells. Mol Ther Methods Clin Dev. 2017;8:131-140.
2.Tanaka M, Tashiro H, Omer B, Lapteva N, Ando J, Ngo M, Mehta B, Dotti G, Kinchington PR, Leen AM, Rossig C, Rooney CM. Vaccination Targeting Native Receptors to Enhance the Function and Proliferation of Chimeric Antigen Receptor (CAR)-Modified T Cells. Clin Cancer Res. 2017;23:3499-3509.
2016年
1.Nakazawa Y, Matsuda K, Kurata T, Sueki A, Tanaka M, Sakashita K, Imai C, Wilson MH, Koike K. Anti-proliferative effects of T cells expressing a ligand-based chimeric antigen receptor against CD116 on CD34(+) cells of juvenile myelomonocytic leukemia. J Hematol Oncol. 2016;9:27.
2015年
2014年
1.Saito S, Nakazawa Y, Sueki A, Matsuda K, Tanaka M, Yanagisawa R, Maeda Y, Sato Y, Okabe S, Inukai T, Sugita K, Wilson MH, Rooney CM, Koike K. Anti-leukemic potency of piggyBac-mediated CD19-specific T cells against refractory Philadelphia chromosome-positive acute lymphoblastic leukemia. Cytotherapy. 2014;16:1257-69.
2013年
1.Nakazawa Y, Saha S, Galvan DL, Huye L, Rollins L, Rooney CM, Wilson MH. Evaluation of long-term transgene expression in piggyBac-modified human T lymphocytes. J Immunother. 2013;36:3-10.
2012年
1.Saha S, Nakazawa Y, Huye LE, Doherty JE, Galvan DL, Rooney CM, Wilson MH. piggyBac Transposon System Modification of Primary Human T Cells. J Vis Exp. 2012;69:e4235.
2011年
1.Nakazawa Y, Huye LE, Salsman VS, Leen AM, Ahmed N, Rollins L, Dotti G, Gottschalk SM, Wilson MH, Rooney CM. PiggyBac-mediated cancer immunotherapy using EBV-specific cytotoxic T-cells expressing HER2-specific chimeric antigen receptor. Mol Ther. 2011;19:2133-43.
2.Huye LE, Nakazawa Y, Patel MP, Yvon E, Sun J, Savoldo B, Wilson MH, Dotti G, Rooney CM. Combining mTor inhibitors with rapamycin-resistant T cells: A two-pronged approach to tumor elimination. Mol Ther. 2011;19:2239-48.
2010年
1.Manuri PV, Wilson MH, Maiti SN, Mi T, Singh H, Olivares S, Dawson MJ, Huls H, Lee DA, Rao PH, Kaminski JM, Nakazawa Y, Gottschalk S, Kebriaei P, Shpall EJ, Champlin RE, Cooper LJ. piggyBac transposon/transposase system to generate CD19-specific T cells for treatment of B-lineage malignancies. Hum Gene Ther. 2010;21:427-37.
2009年
1.Galvan DL, Nakazawa Y, Kaja A, Kettlun C, Cooper LJ, Rooney CM, Wilson MH. Genome-wide mapping of PiggyBac transposon integrations in primary human T cells. J Immunother. 2009;32:837-44.
2.Nakazawa Y, Huye LE, Dotti G, Foster AE, Vera JF, Manuri PR, June CH, Rooney CM, Wilson MH. Optimization of the PiggyBac transposon system for the sustained genetic modification of human T lymphocytes. J Immunother. 2009;32:826-36.