信州大学医学部 分子病態学教室
LOX-1に結合する内因性のリポ蛋白質HEADLINE
LDLの中の何がLOX-1に作用しているのか?
実験で使用される酸化LDLはLDLを銅イオンの触媒下で人工的に酸化したもので、生体内から精製してきたものではない。また、かつては血管壁には酸化LDLが沈着しているものの、血液中には酸化LDLは存在しないと言われていたほどで、実験室で調整した酸化LDLと同じようなものが血管で作用しているのかどうかは決して自明ではない。
そこで、ヒトから採取した血漿からLDLを精製した後、陰イオン交換カラムで電荷により分画してLOX-1への結合およびLOX-1を介した細胞反応を調べると、生体内にもLOX-1に作用するLDL分画が存在することが明らかになった(Tang, D. et al. J Lipid Res 2008、Lu, J. et al. Circ Res 2009)。まず、精製したLDLをイオン交換クロマトグラフィーを用いて電荷により分画した結果、高コレステロール血症の人の血漿中には陰性荷電の強いLDLが存在することがわかり、これは健常人の血漿中にはほとんど認められなかった。このうち最も陰性荷電の強い分画(L5)に血管内皮障害作用があることがわかった。L5を内皮細胞に反応させると、in vitroで調整した酸化LDLの場合と同様に、LOX-1の発現促進、FGF2発現抑制、Aktリン酸化抑制能をもち、アポトーシスを誘発した。
これらの反応はRNAiによってLOX-1の発現を抑制すると阻害され、生体内にLOX-1に作用するある種のLDLが確かに存在することを示す。さらに、喫煙者の血漿中にはこの陰性荷電の強いLDL分画(L5)が非喫煙者よりも多く存在することも明らかになっている(Tang, D. et al. J Lipid Res 2008)。このことは、喫煙による動脈硬化を促進する機序の一端を表しているのかもしれない。L5の実態がどのような構造的変化を伴ったLDLであるのかは今後の課題である。
レムナント
一方、Shinらのグループは、LOX-1が酸化LDLの他に、レムナントリポ蛋白の受容体としても作用している可能性を明らかにした(Shin, HK. et al. Circulation 2004)。小腸から吸収された脂質はapoB48によってカイロミクロンとよばれるリポ蛋白質として運ばれ、血中でリポ蛋白リパーゼによって中性脂肪が分解されることにより、カイロミクロンレムナント、さらにはレムナントリポ蛋白質となって、最終的に肝臓に吸収される。また、高レムナントリポタンパク血症は虚血性心疾患の危険因子として注目されており、レムナントが何らかの形で積極的に動脈硬化を促進させているのではないかと言われてきた。
レムナントをヒト内皮細胞に作用させると、酸化LDLの場合と同様にアポトーシスを引き起こし、この現象には、NAD(P)H oxidase活性化、superoxide産生、TNF-α、IL-1β産生が関与していた。さらに抗LOX-1抗体がレムナントによるアポトーシスを阻害することから、これらのレムナントの作用はLOX-1を介することが明らかになった。このことは、LOX-1が血管内皮細胞でレムナント受容体としても機能し、動脈硬化の進展を促進している可能性を示唆する。
変性HDL
また、Beslerらのグループは、修飾HDLがLOX-1のリガンドとして作用していることを報告した(Besler, C. et al. J Clin Invest. 2011)。つまり、善玉コレステロールと考えられているHDLも、修飾を受けることで内皮機能を障害する悪玉として機能するというのである。
HDLを健常者と冠動脈疾患患者から調整すると、冠動脈疾患患者のHDL(HDLCAD)は健常者のHDL(HDLHealty)に比べて多くのマロンジアルデヒドと結合していた。マロンジアルデヒドは脂質過酸化生成物のひとつで、脂質過酸化の主要なマーカーとしてよく用いられている。冠動脈疾患患者ではPON1(paraoxonase 1)と呼ばれるHDL中に存在する抗酸化酵素の活性が低く、それが原因でこのような修飾が起きていると考えられた。
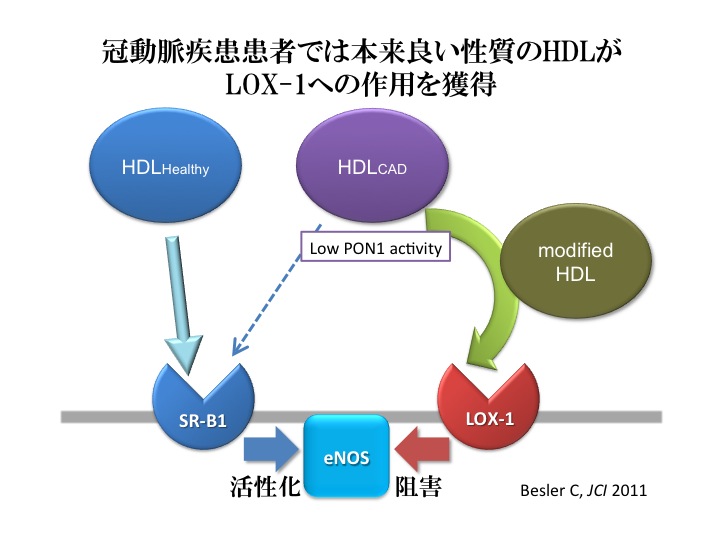
これらのHDLについて、in vitroで血管内皮細胞に対する作用を比較すると、HDLCADにより活性酸素産生の増加、内皮細胞への単球接着の増加が認められた。また、HDLCADは、内皮細胞のPKCβIIの活性化とそれによるeNOSのリン酸化によりeNOS活性を抑制し、NOの産生抑制を引き起こした。これらの作用は抗LOX-1抗体により阻害され、LOX-1を介した作用と考えられた。
つまり、内因性の変性HDLが特に冠動脈疾患患者で多く存在し、LOX-1を介して内皮障害を促進することが明らかになった。このことから、HDLの量だけではなく、その質についても注意することが必要であると考えられる。
このように、LOX-1を介して作用する様々なリポ蛋白が内因性に存在することが明らかとなってきた。これらはそれぞれに動脈硬化性疾患の発症・進展に重要な役割を担っていると考えられる。

参考文献
Lu, J., Yang, J.H., Burns, A.R., Chen, H.H., Tang, D., Walterscheid, J.P., Suzuki, S., Yang, C.Y., Sawamura, T., Chen CH.: Mediation of electronegative low-density lipoprotein signaling by LOX-1: a possible mechanism of endothelial apoptosis. Circ Res. 104:619-27, 2009
Tang, D., Lu, J., Walterscheid, J.P., Chen, H.H., Engler, D.A., Sawamura, T., Chang, P.Y., Safi, H.J., Yang, C.Y., Chen, C.H..: Electronegative LDL circulating in smokers impairs endothelial progenitor cell differentiation by inhibiting Akt phosphorylation via LOX-1. J Lipid Res. 49:33-47, 2008
Shibata, T. et al.: Lipid peroxidation modification of protein generates Nepsilon-(4-oxononanoyl)lysine as a pro-inflammatory ligand. J Biol Chem. 286:19943-57, 2011
Shin, H.K. et al.: Remnant lipoprotein particles induce apoptosis in endothelial cells by NAD(P)H oxidase-mediated production of superoxide and cytokines via lectin-like oxidized low-density lipoprotein receptor-1 activation: prevention by cilostazol. Circulation. 109:1022-8, 2004
Besler C et al.: Mechanisms underlying adverse effects of HDL on eNOS-activating pathways in patients with coronary artery disease. J Clin Invest. 121:2693-708, 2011
研究概要
酸化LDL受容体LOX-1の発見
LOX-1と細胞との相互作用から細胞接着・炎症へ
LOX-1とCRP
LOX-1ブロッカーの開発
LOX-1を用いた診断技術の開発