我々の実験技術 2025/9/9更新
我々の研究室で築き上げた実験技術を紹介します。
当研究室では,化学や生物に関連した様々な知識や実験技術を身につけることが可能です。
これらは,化学はもちろん医薬,工学,食品,農学,環境の分野における研究・開発・分析で役に立つものばかりです。
糸状菌の形質転換技術
Trichoderma 属およびAspergillus 属における形質転換技術を構築しました。
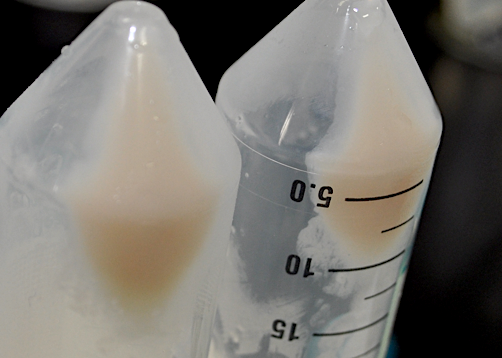
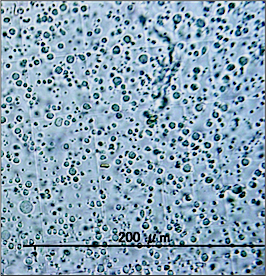
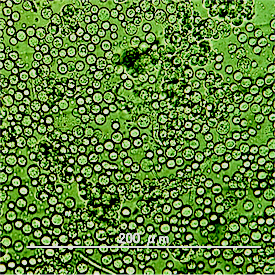
まず,菌糸の細胞壁を溶解酵素で分解してプロトプラストを作製します(図・顕微鏡写真)。そこに,PEG法によって遺伝子を導入して形質転換を行います。細胞 壁溶解酵素の選定や反応条件,遺伝子導入条件など,多くの失敗と経験から,ようやく納得できるプロトコルを完成させることができました。
複数のマーカーを用いた遺伝子の導入
糸状菌で発現するマーカー遺伝子を複数利用することで,多くの遺伝子を導入することを可能にしました。マーカーには,薬剤耐性遺伝子や栄養要求生 株の補完遺伝子などを使用します。遺伝子の導入は,相同組換え,非相同組換えもしくはプラスミドによって糸状菌に導入します。図は薬剤耐性を示すトリコデルマのコロニーです(白い斑点部分)。

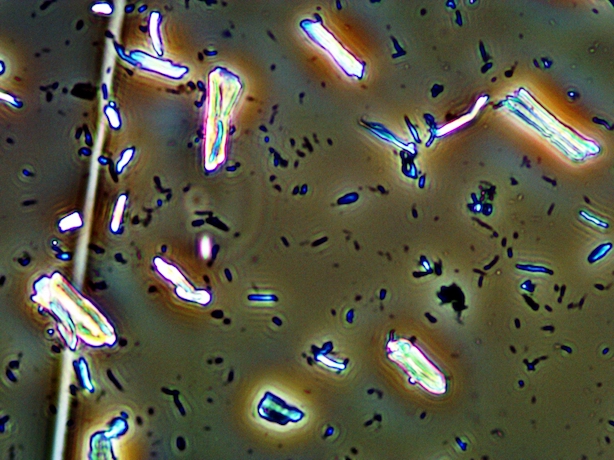
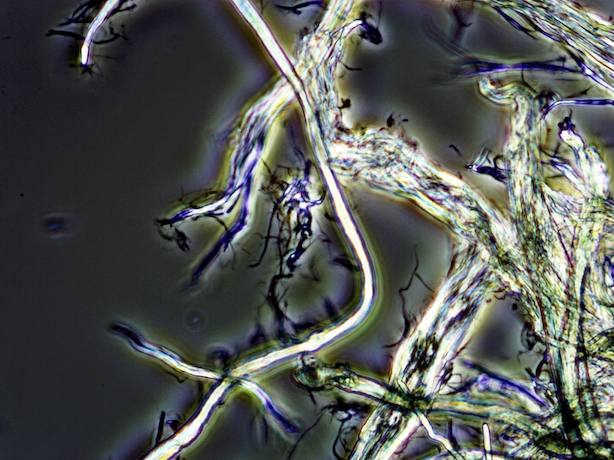
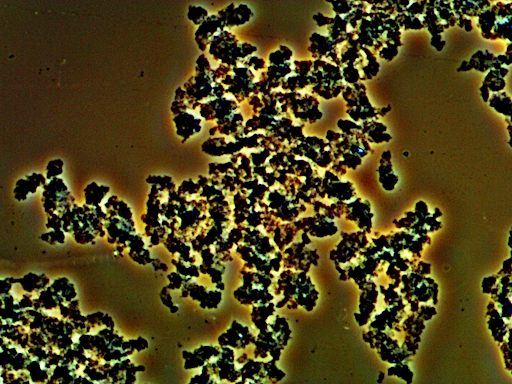
セルロースの光学顕微鏡観察
百聞は一見にしかず。酵素で分解したセルロースの形態を位相差顕微鏡で観察しています(写真)。この顕微鏡は,光の回折と干渉を利用して無色透明な標本に明暗のコントラストをつけて観察することが可能です。通常の光学顕微鏡ではわからないセルロース微粒子の存在,繊維の方向や乱れ具合も観察することができます。下は様々なセルロースを観察したときの写真です。
セルロースの電子顕微鏡観察
酵素による分解の様子をより詳細に確認するために,セルロースを電子顕微鏡(FE-SEM)で観察します。光学顕微鏡の倍率は最高1,000倍程度ですが,こちらは1万倍以上まで拡大できます。


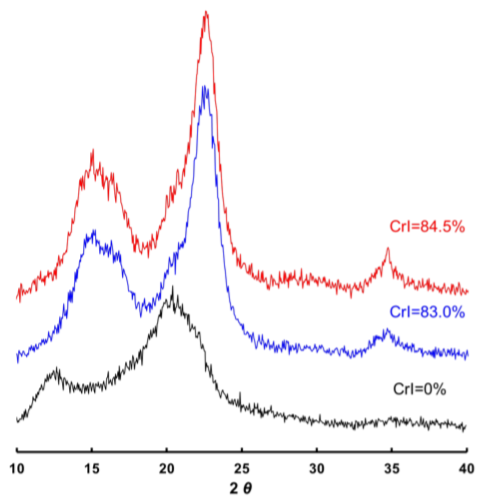
セルロースの結晶化度
セルロース分子は水素結合によって強固な結晶を作っていることは高校の化学の教科書にも載っていますが,その結晶形や結晶化の程度(結晶化度)をX線回折装置(XRD)によって測定します。これらはセルラーゼの反応性に非常に影響します。
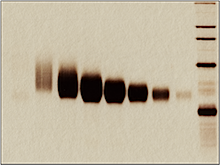
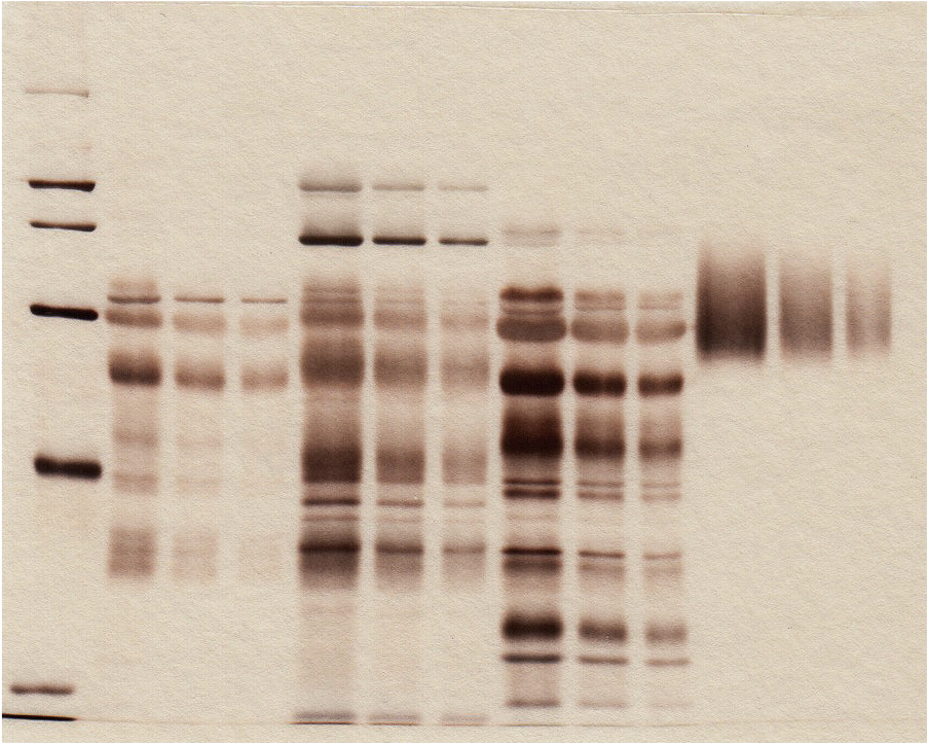
酵素の精製技術
自分でゲルを充填したカラムと天秤式のフラクションコレクターを使用して酵素を大量に精製します。下図は,セルロースカラムに よって精製した酵素の電気泳動写真です。簡単な方法ですが,これを成功させるには特別なコツが必要なんです。
HPLCによる糖質の分析技術
例えば,結合位置の異なるβ-グルコ二糖(β-1,4; β-1,3; β-1,6; β-1,2)とセロオリゴ糖(グルコース〜セロテトラオース)を完全分離し,正確に定量できる条件を確立しました。担当の学生が,非常に複雑なグラジエントプログラムを徹 夜で完成させてくれました。図はその溶出パターンです。
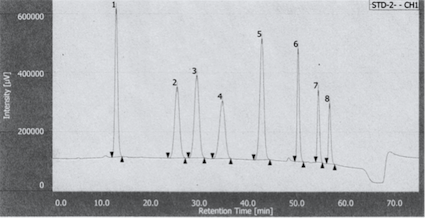
イオンクロマトグラフ(HPAEC-PAD)による糖質の分析
DIONEX ICS-5000+。酵素反応の生成物を高感度で定性・定量することが可能です。電気化学検出器を備えています。単糖,オリゴ糖を高分解能で分析可能です。


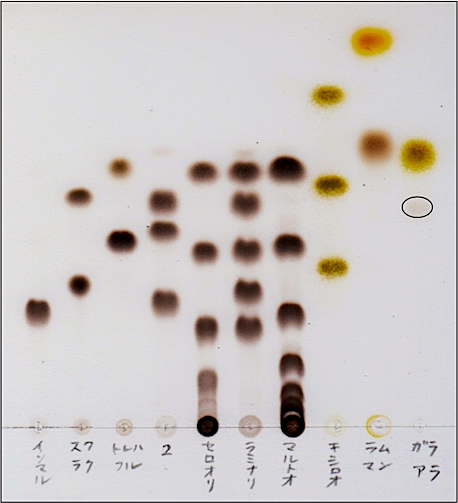
TLC(薄層クロマトグラフィー)による糖質の分析
古典的な方法ですが,視覚的にインパクトを与えるならこれが一番です。複数の試料を同時に視覚的に観察できるからです。
マルトオリゴ等(α-1,4結合),セロオリゴ糖(β-1,4結合),ラミナリオリゴ糖(β-1,3結合),キシロオリゴ糖(β-1,4結合),マンノオリゴ糖(β-1,4結合)それらの単糖類や分岐オリゴ糖を全て同時に分離・同定することが可能です。糖質の種類によってスポットの形状が簿妙に異なるのがわかるでしょうか。さらに,発色剤を変えることで特定の糖質の色を変化できます。
当研究室では,環境と人(の嗅覚)に優しい展開溶媒を開発し,古い展開溶媒でも高い分離能とシャープなスポットを得ることができるようになりました。しかし,下のように展開するにはそれなりの技が必要です。写真はオリゴ糖の分離に適した展開溶媒で分析した結果です。

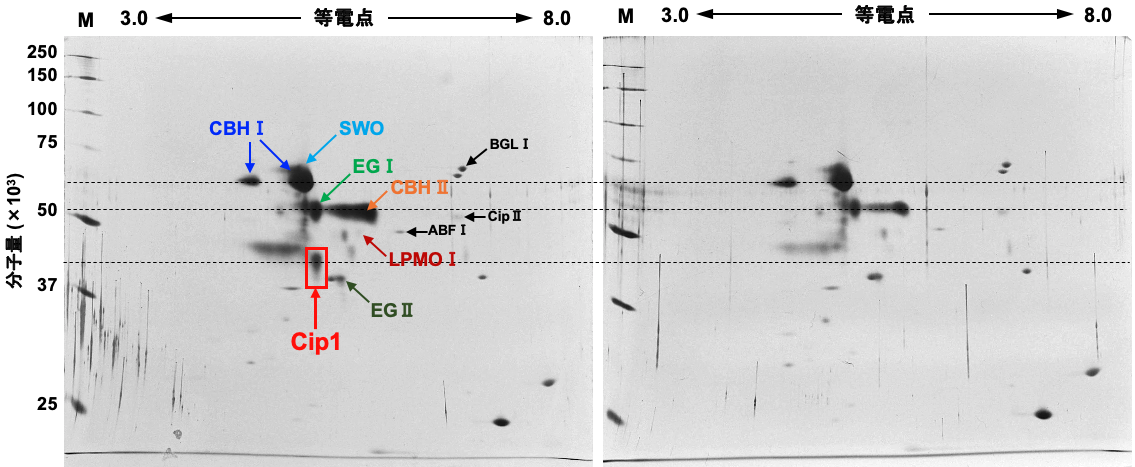
タンパク質の分子量・等電点(二次元電気泳動による解析)
等電点電気泳動とSDS-PAGEを組み合わせた二次元電気泳動によって各種タンパク質を分析します。下の図 は,トリコデルマ・リーゼイが生産する培養液(酵素溶液)をSDS-PAGEに供したと結果(左)と二次元電気泳動で分析した結果(右)です。
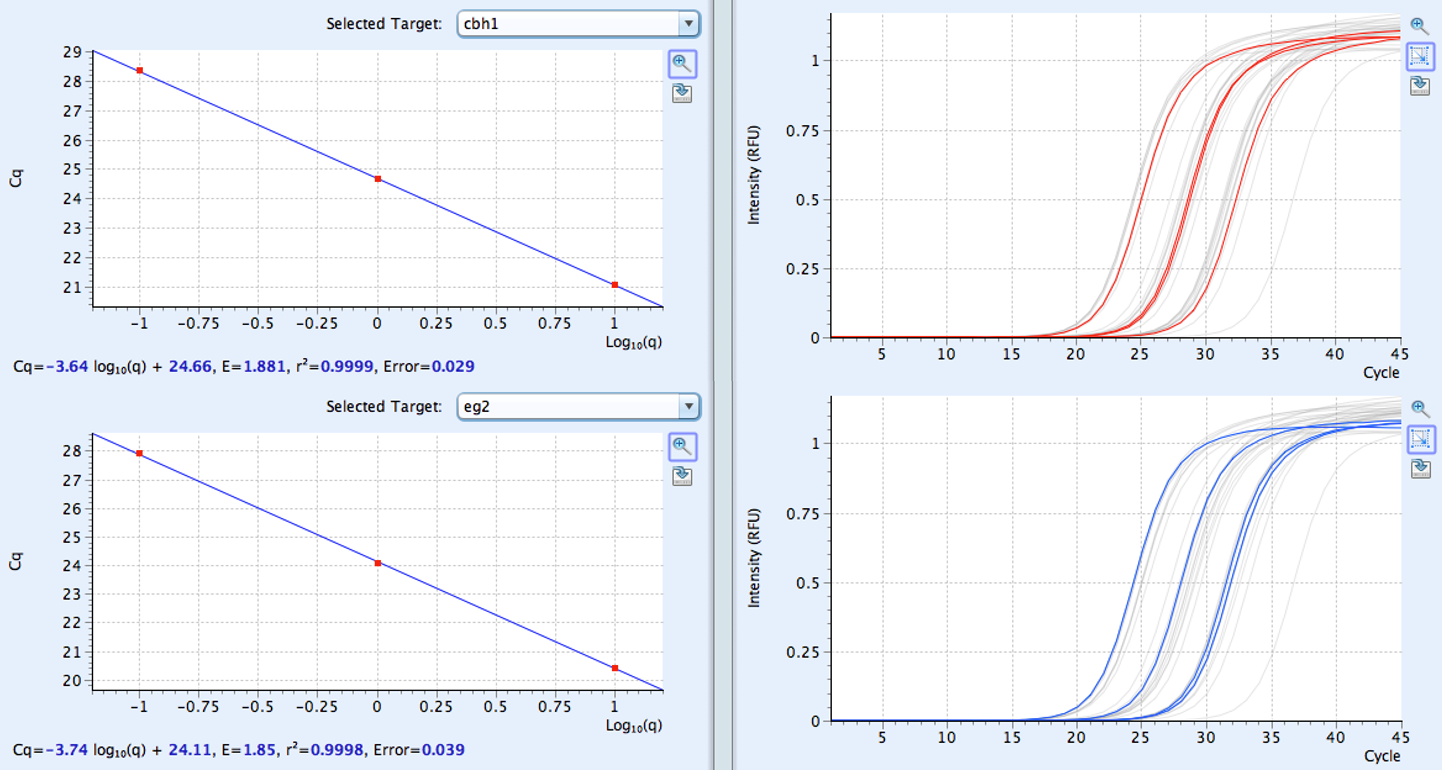
遺伝子発現量(リアルタイムPCR)とタンパク質発現量(ウェスタンブロッティング)
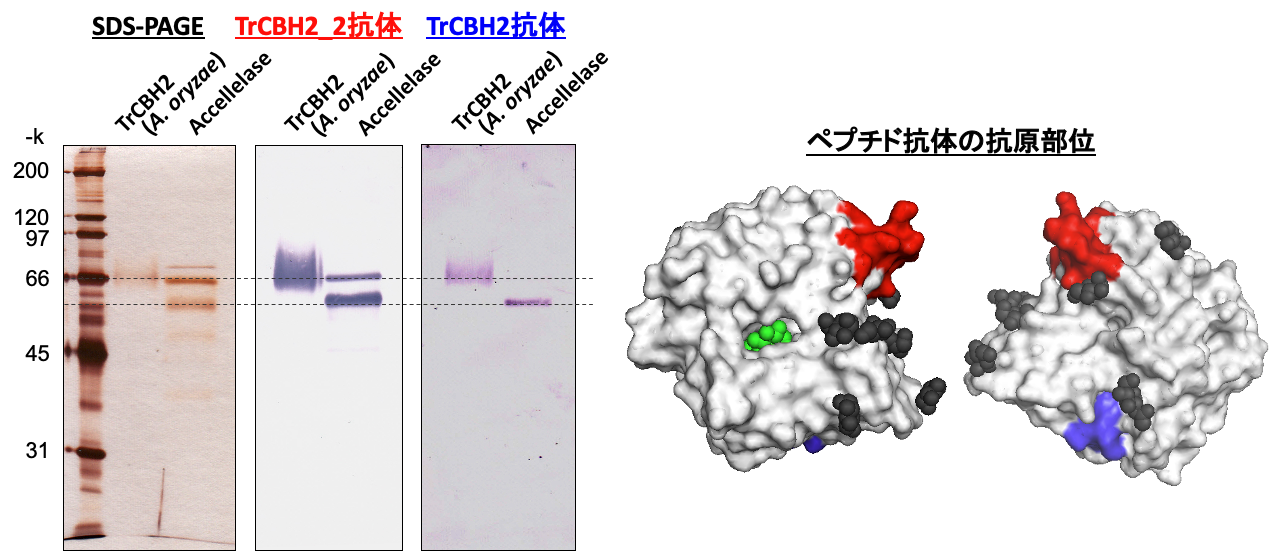
酵素の遺伝子発現量は,リアルタイムPCR(上)によって定量します。また,酵素のタンパク質レベルでの発現量は,その酵素に特異的な抗体を使用したウェスタンブロッティング法(下)によって測定します。
各種バイオマス分解酵素を保有しています
本研究室では精製した酵素を多数保有しています。
また,大部分についてはその特性を調査してあります。少量であれば,お分けすることが可能なものもございます。
| 酵素化学研究室で保有しているバイオマス分解酵素 |
||
| 酵素の起源 |
酵素の慣用名など |
酵素の名称など (アミノ酸配列などの情報は こちら) |
| 糸状菌 Trichoderma reesei QM6a Trichoderma reesei QM9414 Trichoderma reesei RUT C-30 |
β-グルコシダーゼ |
Cel1A (BGL II) Cel1B Cel3A (BGL I) Cel3B Cel3C Cel3D Cel3E Cel3F Cel3G (BGL 3I) Cel3H |
| エキソ型セルラーゼ |
Cel7A (Cellobiohydrolase, CBH I) Cel6A (Cellobiohydrolase, CBH II) |
|
| エンド型セルラーゼ |
Cel5A (Endo-1,4-β-glucanase, EG II) Cel7B (Endo-1,4-β-glucanase, EG I) Cel12A (Endo-1,4-β-glucanase, EG III) Cel45A (Endo-1,4-β-glucanase, EG V) |
|
| キシラン分解酵素 | Xyn11A (Xylanase, XYN I) Xyn10A (Xylanase, XYN III) Xyn30A (Xylanase, XYN IV) Xyn30B (Xylanase, XYN VI) Bxl3A (β-xylosidase, BXL I) Abf54A (α-L-arabinofuranosidase, ABF I) Cip2 (4-O-methyl-glucuronoyl methylesterase, CE15) Glr67A (α-glucuronidase, GLR I) |
|
| ガラクトマンナン 分解酵素 |
Bma2A (1,4-β-mannosidase, BMA I) Man5A (1,4-β-mannanase, MAN I) Agl27A (α-galactosidse, AGL I) Agl27B (α-galactosidse, AGL III) Agl27C (α-galactosidse, AGL IV) Agl27D (α-galactosidse, AGL V) Agl36A (α-galactosidse, AGL II) |
|
| ガラクタン分解酵素 | Bga35A (β-galactosidse, BGA I) Gan5A (Endo-1,6-β-galactanase, EnGAN I) |
|
| ペクチン分解酵素 | XGH28A (Endo-xylogalacturonase, EndoXGH I) PG28A (Endo-polygalacturonase, EndoPG I) PG28B (Exo--polygalacturonase, ExoPG I) RGH28A (Exo-rhamnogalacturonase, ExoGH I) |
|
| 1,3-1,6-β-グルカン分解酵素 |
BG5A (Deduced endo-1,6-β-glucanase) BG16A (Deduced endo-1,3-β-glucanase) BG55A (Exo-1,3-β-glucanase) BG55B (Deduced endo-1,3-β-glucanase) BG55E (Deduced endo-1,3-β-glucanase) BG30A (Deduced endo-1,6-β-glucanase) |
|
| その他 |
Cel74A (Xyloglucanase, EG VI) Swo1 (Swollenin, SWO I) EEL1 (Expansin/family-45 endoglucanase-like domain 1) EEL2 (Expansin/family-45 endoglucanase-like domain 2) EEL3 (Expansin/family-45 endoglucanase-like domain 3) Cel61A LPMO9A (EG IV, LPMO I, AA9) Cel61B LPMO9B (EG VII, LPMO II, AA9) Cip1 (Unkown function) Gl20A (1,4-β-glucuronan lyase, GLA I) Hfb2 (Hydrophobin, HFB II) Cut5A (Cutinase, CUT I, CE5) Endo T (Endo-N-acetyl-β-D-glucosaminidase, ENGase I, GH18) |
|
| 白色腐朽菌 Irpex lacteus MC2 |
セルロース分解酵素 | Cel5A (Cellobiohydrolase, En-1) Cel6A (Cellobiohydrolase, Ex-3) Cel7A (Endo-1,4-β-glucanase, Ex-1) |
| その他 |
CDH (Cellobiose dehydrogenase, CDH I) Gan45A (Exo-1,3-β-galactanase, ExGAN I) RGH28A (Endo-rhamnogalacturonase, EnRGH I) |
|
| アカパンカビ Neurospora crassa OR74A |
LPMO |
LPMO9C (NCU02916, C-4 oxidizing AA9) LPMO9 (NCU00836, C-1 oxidizing AA9) LPMO9 (NCU07760, C-1:C-4 oxidizing AA9) |
| 白色腐朽菌 Trametes hirsuta カワラタケ |
エンド型セルラーゼ | Cel5A (Endo-1,4-β-glucanase, EG1) |
| ラッカーゼ | Lcc1 | |
| 好温性糸状菌 Humicola insolens |
β-グルコシダーゼ | Bgl1A (BGL I) |
| 麹菌 Aspergillus oryzae RIB40 |
各種 |
Glucoamylase A (Glucoamylase A, GlaA) Cut5A (Cutinase, CUT I, CE5) Cut5B (Cutinase, CUT II, CE5) Cut5C (Cutinase, CUT III, CE5) Cut5D (Cutinase, CUT IV, CE5) Cut5E (Cutinase, CUT V, CE5) Pme8A (Pectin methylesterase, PME A, CE8) RGH28A (Endo-rhamnogalacturonan hydrolase) TanA (Tannase, TAN A, CE1) TanB (Tannase, TAN B, CE1) AphA (Acid phosphatase, Phytase) BG5A (Endo-1,6-β-glucanase) BG5B (Exo-1,3-β-glucanase) BGL3H (β-1,6-glucosidase, GH3) Cel131A (Unkown function, GH131) |
| 枯草菌 Bacillus subtilis |
エクスパンシン |
EXLX1 (Expansin-like protein, YoaJ) |
| 酢酸菌 AY-201 |
エンドグルカナーゼ | Cel8A (Endo-1,4-β-glucanase, CMCax) |
| 白色腐朽菌 Trametes sp. カワラタケ属 |
ラッカーゼ |
Lcc1 |
| 白色腐朽菌 トキイロヒラタケ |
ラッカーゼ |
Lcc1 Lcc2 Lcc3 Lcc4 Lcc9 |
| 担子菌 ツクリタケ |
ラッカーゼ | LccA |
| 大腸菌 K-12 |
UidA (β-Glucuronidase, GUS) |
|
| リンゴ フジ、シナノゴールド |
エクスパンシン | α-Expansin (MdEXPA16) α-Expansin (MdEX-PA1) Expansin like protein (MdEXLA2) Expansin like protein (MdEXLB2) |
