β-グルコシダーゼのグルコース感受性を改善する研究
β-グルコシダーゼの役割
β-グルコシダーゼ(BGL)はセロビアーゼともよばれ,1分子のセロビオースを2分子のグルコースに加水分解する酵素です。トリコデルマでは,細胞外のBGL活性は低く,セルロースの分解物としてセロビオースが蓄積する傾向があります。一方,Cel1Aという細胞内BGLが存在し,セルラーゼの誘導物質であるソホロースを糖転移反応で合成していることが予想されています。
BGLの弱点として,生成物であるグルコースが存在すると活性が低下する生成物阻害が起こります。Cel1Aもグルコースによって活性が著しく低下します。BGLにグルコース耐性を与え,生成物阻害を回避することは,セルロースの酵素分解において極めて重要な要素であり,トリコデルマCel1Aにおいてもセルラーゼ誘導の能力を強化できる1つの戦略としてと考えられています。
参考文献
■ Guo B, Sato N, Biely P, Amano Y, Nozaki K (2016) Comparison of catalytic properties of multiple β-glucosidases of Trichoderma reesei.
Appl Microbiol Biotechnol, DOI: 10.1007/s00253-016-7342-x.
グルコース耐性・グルコース活性促進するβ-グルコシダーゼが存在する
多くのBGLが生成物阻害を示す中で,高いグルコース耐性に加えて活性促進を示すBGLがいくつか報告されています。糸状菌Humicola insolens のBGL(HiBGL)は,熱安定性が高いだけでなく,グルコースが存在すると加水分解活性が約2倍に増加し,さらに高いグルコース耐性を示します。我々の研究室では,この性質をトリコデルマのCel1Aに付与する研究を行ってきました。
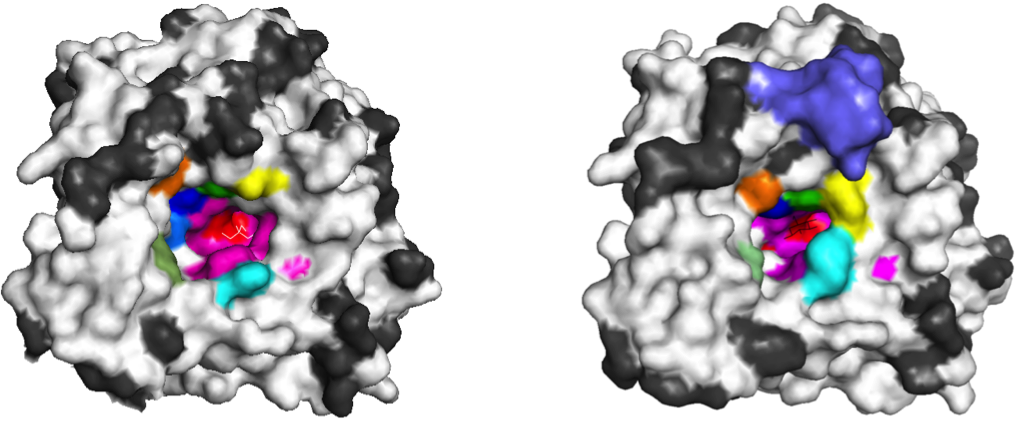
β-グルコシダーゼの立体構造の比較
黒:両酵素を比較して性質が違うアミノ酸,白;性質が同じアミノ酸残基
赤・ピンク:活性部位近傍のアミノ酸(両酵素で完全に一致)
紫:HiBGLに特徴的な構造(活性部位から離れた部分)
カラー:活性部位入口の異なるアミノ酸(両酵素で全て異なる)
BGLの立体構造に関する参考文献
■ Jeng WY et al. (2011) Structural and functional analysis of three β-glucosidases from bacterium Clostridium cellulovorans, fungus Trichoderma reesei and termite Neotermes koshunensis. J Struct Biol, 173, 46ー56.
■ de Giuseppe PO et al. (2014) Structural basis for glucose tolerance in GH1 β-glucosidases. Acta Crystallogr D Biol Crystallogr, 70, 1631ー1639.
研究は,両酵素の立体構造の比較から始まりました。アミノ酸配列を比較して,その違いを表した結果が上の図です。酵素反応に直接関係する活性部位近傍のアミノ酸の種類は両酵素で完全に一致していることがわかります(赤・ピンク色)。一方,活性部位入口のアミノ酸の種類は大きく異なり(カラーの部分),それによって活性部位の入口の大きさにも差があることがわかります。HiBGLの活性部位入口は,Cel1Aに比較して狭く小さいことがわかります。
両酵素の活性部位入口のアミノ酸の違いが,グルコースに対する性質の差に起因していることが予想されます。このことから,HiBGLの構造をお手本に,Cel1Aの構造改変(アミノ酸残基の変更)を遺伝子工学的手法を用いて実施しました。
変異型Cel1Aのグルコース耐性
Cel1Aにおいて,いくつかのアミノ酸を変更した変異型Cel1Aを作製し,そのグルコースに対する性質を調査しました。驚くべきことに,その中でHiBGLと同様にグルコース耐性かつグルコース活性化を示す変異型Cel1Aを得ることができました。
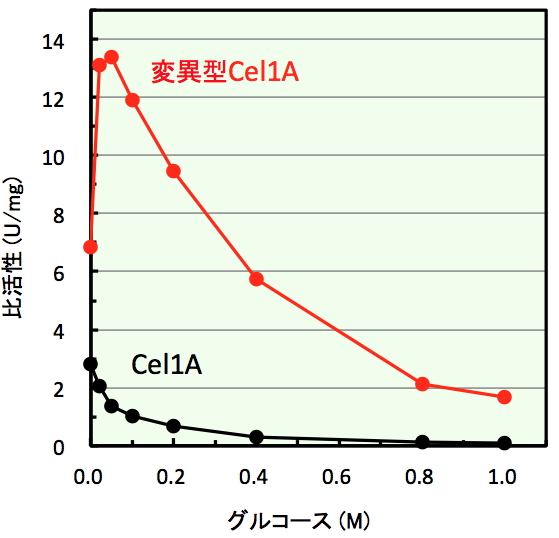
変異型Cel1Aのグルコース耐性
黒:野生型Cel1A(グルコース耐性なし),赤:変異型Cel1A (グルコース耐性あり・活性化あり)
黒:野生型Cel1A(グルコース耐性なし),赤:変異型Cel1A (グルコース耐性あり・活性化あり)
変異型Cel1Aは,グルコース耐性・活性化を示しただけでなく,グルコース非存在下での比活性が約2倍に増加しました。また,Cel1Aがもっているソホロース合成活性も野生型と同様に保持していることが明らかとなりました。酵素化学研究室では,この性質の変化がどのような機構で発現しているのかを決定しました。
参考文献
■ Guo B, Amano Y, Nozaki K (2016) Improvements in glucose sensibility and stability of Trichoderma reesei β-glucosidase using site-directed mutagenesis. PLOS ONE, DOI: 10.1371/journal.pone.0147301.
研究のゴール
高いグルコース耐性とグルコース活性促進を示す変異型Cel1Aは,酵素の立体構造と触媒活性に重要な関連性があることを明らかにしてくれました。我々は今,変異型Cel1Aの遺伝子をトリコデルマへ組み込む研究に取り組んでいます。この研究は,セルラーゼ誘導の研究と相まってトリコデルマにおけるセルラーゼ生産量の増加を目指しています。
一方,Cel1Aは耐熱性が低く不安定なBGLです。他の部位への変異を導入し,HiBGLのように耐熱性を上げる研究にも取り組んでいます。
