CRISPR-Cas3による新たなin vivoゲノム編集技術を開発―モデルマウスの肝臓でトランスサイレチン遺伝子の特異的欠失に成功―
【発表のポイント】
◆CRISPR-Cas3を搭載したmRNA-LNPを用いて、in vivo(マウス肝臓)でゲノム編集することにより、血中トランスサイレチン(TTR)量を約80%低下させることに成功しました。
◆従来のCRISPR-Cas9と異なり、CRISPR-Cas3はTTR遺伝子を主に一方向に広範囲に欠失させ、隣接遺伝子への影響は最小限で、オフターゲット変異が検出されない安全な編集プロファイルを示しました。
◆CRISPR-Cas9による編集では3塩基欠失などインフレーム変異(IFM)によりアミロイド化する潜在的なリスクのあるタンパク質が確認された一方で、CRISPR-Cas3ではそのような異常タンパク質は検出されませんでした。
◆今後、より確実で安全なin vivo遺伝子治療法の新たな選択肢として、CRISPR-Cas3の臨床応用が期待されます。
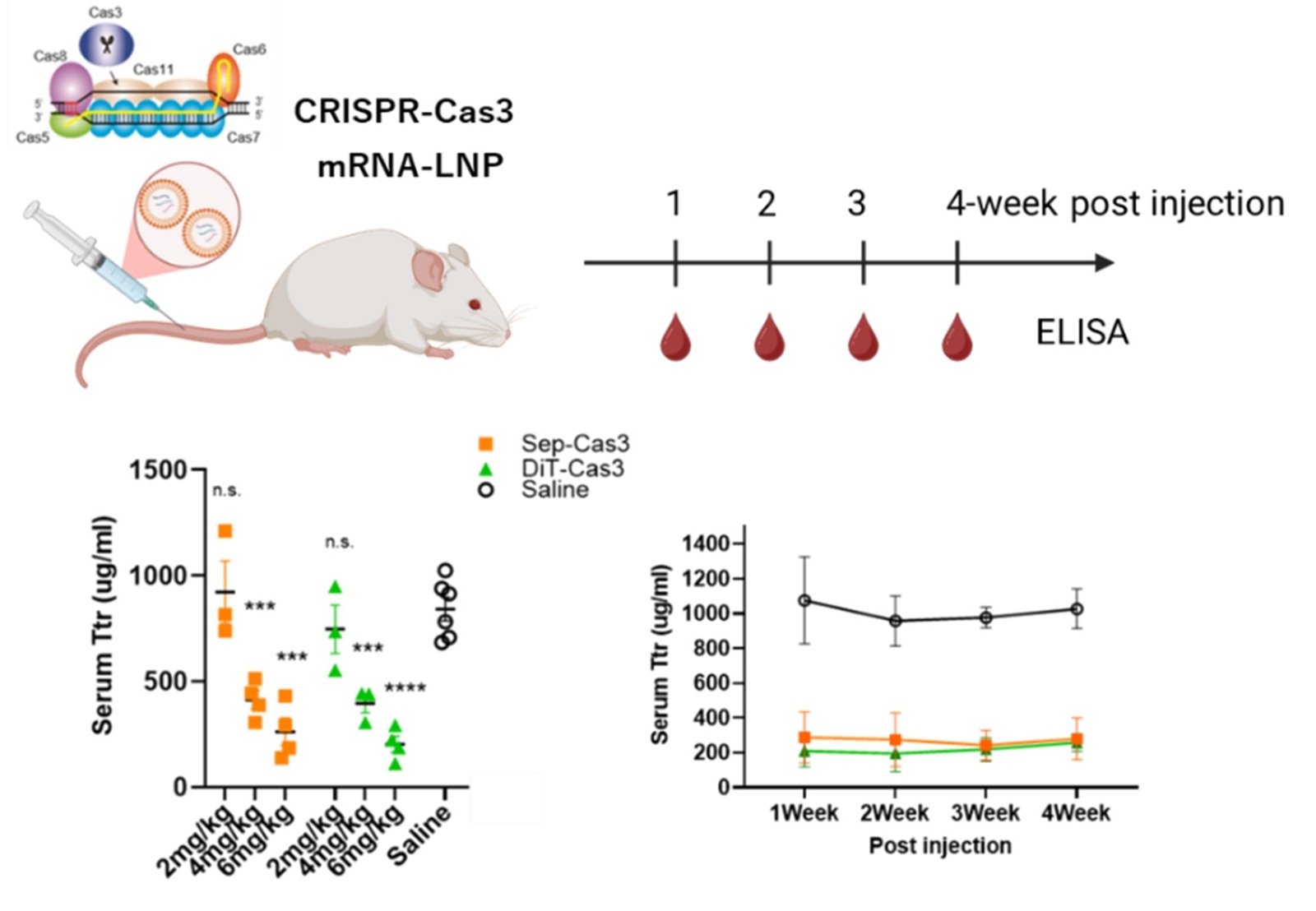
CRISPR-Cas3 mRNA-LNPによるマウスin vivoゲノム編集
【概要】
東京大学医科学研究所先進動物ゲノム研究分野の真下知士教授、石田紗恵子助教らの研究グループは、北海道大学大学院薬学研究院の佐藤悠介准教授、信州大学医学部の関島良樹教授、名古屋大学糖鎖生命コア研究所・大学院理学研究科の阿部洋教授、東京科学大学 総合研究院 難治疾患研究所 高地雄太教授、同 生体材料工学研究所 山口健介特任助教、理化学研究所などとの共同研究により、国産ゲノム編集技術 CRISPR-Cas3(注1)を生体内で応用する新たな手法の開発に成功しました(特許出願済み)。
本手法は、CRISPR-Cas3システムをメッセンジャーRNA(mRNA)として脂質ナノ粒子(LNP)(mRNA-LNP:注2)に搭載し、体内に投与することで標的臓器の遺伝子をゲノム編集する技術です。今回の研究では、肝臓に特異的に送達されるLNPを用いることで、肝臓遺伝子の効率的なゲノム編集に初めて成功しました。
今回標的としたトランスサイレチン(TTR)遺伝子は、肝臓で産生されるトランスサイレチンタンパク質(TTR)が変性してアミロイドとして蓄積し、心臓や神経に障害をもたらす難治性疾患トランスサイレチンアミロイドーシス(ATTR)(注3)の原因遺伝子です。TTRの産生抑制による治療効果が明らかになっていますが、既存治療は長期間の継続投薬を要する点が課題です。
本研究では、CRISPR-Cas3を搭載したLNPを投与することで、マウス肝臓のTTR遺伝子を生体内で直接ノックアウト(破壊)しました。その結果、一度の投与で、継続して血中TTR量が約80%減少し、心臓組織におけるTTR沈着および、それに伴う異物除去細胞であるマクロファージの浸潤が明らかに抑制されました。
これらの成果は、CRISPR-Cas3を用いた新しいin vivo遺伝子治療法の実現可能性を示すものであり、ATTRのみならず他の遺伝性疾患への応用にもつながることが期待されます。
本研究成果は、2026年1月5日付で、英国科学誌「Nature Biotechnology」のオンライン版で公開されました。
【発表内容】
〈研究の背景〉
ゲノム編集技術は、生物のゲノムDNAを狙った場所で切断し、遺伝子の働きを改変できる技術です。この技術を治療へ応用することで、病気の原因となる遺伝子を修正したり、不要な遺伝子を除去したりすることが可能になります。現在最も広く利用されているゲノム編集技術CRISPR-Cas9は、ハサミのようにDNAを切断して遺伝子をノックアウト(破壊)する方法ですが、切断後のDNA修復過程で予期せぬ変異(特に、新たな機能を持つタンパク質が生じる可能性のあるインフレーム変異:注4)が発生することや、編集可能な範囲の制約が課題となっています。
真下教授らが開発した国産のゲノム編集技術CRISPR-Cas3は、長いDNA領域を削除できる特性を持ち、特定遺伝子を確実に破壊できることが大きな利点です。また、CRISPR-Cas9と比べて長い標的配列を必要とするため、高い特異性を維持しやすいことも特徴です。その結果、CRISPR-Cas9より安定した遺伝子破壊効果やオフターゲット変異(注5)の低減が期待されています。
今回の研究では、CRISPR-Cas3システムを生体内(in vivo)で安全かつ効率的にゲノム編集させる方法を新たに開発し、難治性疾患であるトランスサイレチンアミロイドーシス(ATTR)のマウスモデルを用いてその治療効果を検証しました。
ATTRは、主に肝臓で作られるトランスサイレチン(TTR)が変性してアミロイドとして蓄積し、心臓や神経に障害を生じる疾患です。現在ではRNA干渉薬やTTR安定化薬によりTTR産生の抑制が可能ですが、長期投与が必要で根本的治療には至りません。本研究は、CRISPR-Cas3によるゲノム編集を用いてTTR遺伝子そのものを生体内で不活化するという、根本治療を目指す新しいアプローチを実証した点に大きな意義があります。
〈研究の内容〉
本研究では、まずマウスTtr遺伝子を標的とするガイドRNA(crRNA)を設計し、CRISPR-Cas3による最適なゲノム編集条件を検討しました。その結果、マウス肝細胞Hepa1-6において約60%の高効率でTtr遺伝子を破壊できるcrRNA(#2)を特定しました。また、詳細なゲノム解析により標的外での編集(オフターゲット変異)が認められないことが確認され、CRISPR-Cas3の安全性が示されました。(図1)
 図1:CRISPR-Cas3(vs Cas9)ゲノム編集によるオフターゲット解析
図1:CRISPR-Cas3(vs Cas9)ゲノム編集によるオフターゲット解析
次に、crRNAおよびCas3/Cascade(Cas5, 6, 7, 8, 11)のmRNAに化学修飾を施し、肝臓へ集中的に送達できる脂質ナノ粒子(LNP)に搭載しました。このCas3 mRNA-LNPをマウスに投与したところ、投与1週間後に血中TTRタンパク質が約80%減少し、その効果は4週間以上持続しました。さらに、ヒトのTTR遺伝子を持つマウスに投与した結果、高齢個体で観察されるTTR沈着および、それに伴う異物処理細胞(マクロファージ)の浸潤が顕著に抑制されることが明らかになりました。(図2)
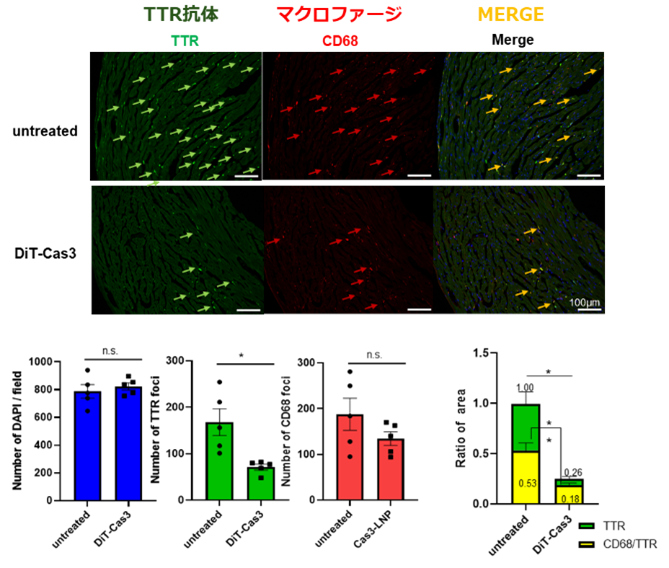
図2:CRISPR-Cas3 in vivoゲノム編集による心臓TTR沈着およびマクロファージ浸潤の抑制
対照として、現在臨床試験に用いられているCRISPR-Cas9システム(NTLA-2001)を同じLNPに搭載し投与したところ、血中TTRの著しい低下が確認された一方で、3塩基欠失などインフレーム変異(IFM)により四量体不安定性の高い変異型TTRタンパク質が検出されました。このIFM変異タンパク質は、遺伝性ATTRで報告される変異型TTRと類似した性質を持ち、アミロイド化する潜在的なリスクが示唆されました。一方、CRISPR-Cas3ではこのようなIFM変異タンパク質は検出されず、安全性の観点からCRISPR-Cas3の優位性が示されました。(図3)
 図3:Cas9編集マウスに認められたインフレーム変異(IFM)
図3:Cas9編集マウスに認められたインフレーム変異(IFM)また、ヒトTTR遺伝子を標的とするcrRNAの最適化も行いました。ヒト肝細胞由来の細胞株HepG2で評価した結果、crRNA(UT-05)はCRISPR-Cas9(NTLA2001)と同等の遺伝子破壊効率を示しながら、オフターゲット変異は検出されず、安全性が改めて確認されました。(図4)
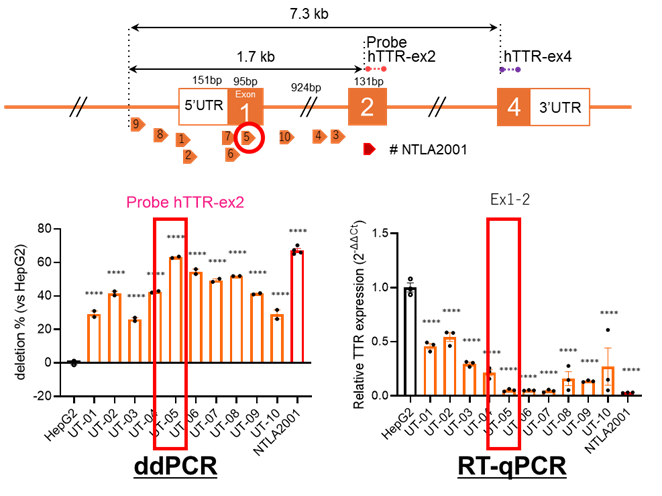 図4:ヒトTTR遺伝子を標的とするCRISPR-Cas3(UT-05)によるヒト肝細胞ゲノム編集
図4:ヒトTTR遺伝子を標的とするCRISPR-Cas3(UT-05)によるヒト肝細胞ゲノム編集
〈今後の展望〉
本研究は、CRISPR-Cas3を用いたin vivoゲノム編集がトランスサイレチンアミロイドーシス(ATTR)の治療に有望であることを示しました。CRISPR-Cas3システムは標的遺伝子を広範囲に削除でき、確実な遺伝子破壊が可能であり、オフターゲットリスクも低いことが明らかとなりました。
今後は、本技術のさらなる安全性評価と最適化を進めることで、ATTRのみならず他の遺伝性疾患に対する遺伝子治療法としての臨床応用が期待されます。特に、CRISPR-Cas9で問題となっている変異型タンパク質の生成リスクを回避できる点は大きな利点であり、新たな治療選択肢の一つとなる可能性があります。
国産のゲノム編集技術CRISPR-Cas3による効率的かつ安全な遺伝子編集を実現するため、mRNAやLNPの改良、投与方法の検討、そして長期的な安全性試験を含む臨床応用に向けた研究を今後も進めていく予定です。
なお、本研究は、東京大学における動物実験審査委員会の承認(承認番号:A21-57)のもと、東京大学が定めた実験動物の取り扱いに関する指針に則り実施されました。
【発表者・研究者等情報】
東京大学医科学研究所
附属実験動物研究施設 先進動物ゲノム研究分野
真下 知士 教授
吉見 一人 准教授
石田 紗恵子 助教
附属疾患プロテオミクスラボラトリー
尾山 大明 准教授
秦 裕子 シニアエキスパート(技術)
北海道大学
大学院薬学研究院 薬剤分子設計学研究室
佐藤 悠介 准教授
信州大学
医学部 内科学第三教室(脳神経内科・リウマチ・膠原病内科)
関島 良樹 教授
東京科学大学
総合研究院
難治疾患研究所ゲノム機能多様性分野
高地 雄太 教授
生体材料工学研究所 医歯理工融合研究イノベーションセンター
山口 健介 特任助教
名古屋大学
糖鎖生命コア研究所・大学院理学研究科 理学専攻化学講座
阿部 洋 教授
大学院理学研究科 理学専攻化学講座
阿部 奈保子 特任准教授
理化学研究所
放射光科学研究センター・生物系ビームライン基盤グループ
竹下 浩平 研究員
【論文情報】
雑誌名:Nature Biotechnology
題 名:CRISPR/Cas3-based editing for targeted deletions in a mouse model of transthyretin amyloidosis
著者名:Saeko Ishida, Yusuke Sato, Keisuke Chosa, Eri Ezawa, Yuko Yamauchi, Masaaki Oyama, Hiroko Kozuka-Hata, Rina Ito, Rikako Sato, Masatoshi Maeki, Tomo-o Ishikawa, Kenichi Yamamura, Kohei Takeshita, Kensuke Yamaguchi, Yuta Kochi, Fumitaka Hashiya, Yiwei Liu, Naoko Abe, Hiroshi Abe, Yoshiki Sekijima, Kazuto Yoshimi, Tomoji Mashimo*(*Corresponding author)
DOI:10.1038/s41587-025-02949-6
URL:https://www.nature.com/articles/s41587-025-02949-6
【研究助成】
本研究は、日本学術振興会(JSPS)科研費(課題番号:23H00367)および日本医療研究開発機構(AMED)令和5年度 再生・細胞医療・遺伝子治療実現加速化プログラム「CRISPR Cas3 mRNA LNP モダリティによる安全な in vivoゲノム編集治療基盤の構築」(課題管理番号JP23bm1223009h0001)の支援を受けて実施されました。
【用語解説】
(注1)CRISPR-Cas3
多くの細菌は、CRISPR-Cas(クリスパー・キャス)システムと呼ばれる獲得免疫に似た防御機構を備えています。CRISPR-Cas3はその中でもクラス1に属する多因子型のCRISPRシステム で、CRISPR-Cas9とは作動原理が大きく異なります。CRISPR-Cas3はDNAを広範囲かつ主に一方向に削除する特徴を持ち、crRNAによる標的配列認識の長さが長いため、高い特異性と確実な遺伝子破壊効果が期待されます。現在、国産ゲノム編集ツールとして開発が進められています。
(注2)mRNA-LNP(脂質ナノ粒子によるmRNAデリバリー)
mRNAを脂質ナノ粒子(LNP)に封入し、体内の細胞へ安全かつ効率的に届ける技術です。COVID-19ワクチンにも用いられたプラットフォームで、遺伝子編集ツール(CRISPR-Cas9やCRISPR-Cas3など)を体内で発現させるデリバリーとして利用されます。mRNAや翻訳されたタンパク質は速やかに分解され長期残存しないため、安全性の高い投与が可能です。今回の研究では、mRNA-LNPをマウスに投与し、肝臓内で直接CRISPR-Cas3が働くin vivoゲノム編集を実現しました。
(注3)トランスサイレチンアミロイドーシス(ATTR)
肝臓で作られるトランスサイレチン(TTR)というタンパク質が変性し、アミロイドとして全身に蓄積することで生じる進行性の難治性疾患です。心アミロイドーシスや末梢神経障害を引き起こします。TTR四量体を安定化する治療薬や、TTR産生を抑制する核酸医薬が実用化されていますが、根治には至っていません。
(注4)インフレーム変異(IFM:in-frame mutation)
DNAの3塩基単位(コドン)を保ったまま挿入・欠失が生じる変異。タンパク質の読み枠が保たれるため、完全に破壊されず、異常な機能を持つタンパク質が産生される可能性があります。本研究では、CRISPR-Cas9編集によるインフレーム変異に由来する変異TTRが検出された一方、CRISPR-Cas3編集では検出されませんでした。
(注5)オフターゲット変異(off-target mutation)
意図しない(標的としない)ゲノム領域が誤ってゲノム編集されることで、がんなどを引き起こす変異が挿入される可能性があります。遺伝子治療において懸念の一つですが、今回のCRISPR-Cas3では、詳細なゲノム解析により再現性のあるオフターゲット変異は検出されませんでした。
【問合せ先】
〈研究内容について〉
東京大学医科学研究所 附属実験動物研究施設 先進動物ゲノム研究分野
教授 真下 知士(ましも ともじ)
Tel:03-6409-2230 E-mail:mashimo[at]ims.u-tokyo.ac.jp
信州大学 医学部医学科 内科学第三教室(脳神経内科・リウマチ・膠原病内科)
教授 関島 良樹(せきじま よしき)
Tel:0263-37-2671 E-mail: sekijima[at]shinshu-u.ac.jp
〈機関窓口〉
東京大学医科学研究所 プロジェクトコーディネーター室(広報)
Tel:090-9832-9760 E-mail:koho[at]ims.u-tokyo.ac.jp
北海道大学 社会共創部広報課
Tel:011-706-2610 E-mail: jp-press[at]general.hokudai.ac.jp
信州大学 総務部総務課広報室
Tel:0263-37-3056 E-mail: shinhp[at]shinshu-u.ac.jp
東京科学大学 総務企画部 広報課
Tel:03-5734-2975 E-mail:media[at]adm.isct.ac.jp
名古屋大学 総務部広報課
Tel:052-558-9735 E-mail:nu_research[at]t.mail.nagoya-u.ac.jp
理化学研究所 広報部 報道担当
Tel:050-3495-0247 E-mail: ex-press[at]ml.riken.jp
上記の[at]は@に置き換えてください.

