信州大学医学部 分子病態学教室
LOX-1を用いた診断技術の開発HEADLINE
狭心症や心筋梗塞、脳血管障害などの動脈硬化性疾患の発症リスク評価法および発症診断法の確立は、これらの疾患の治療と同じくらい重要な課題である。そこで、私達は(酸化)変性LDLやLOX-1そのものの測定をこれらの評価・診断法に応用することを考えている。
バイオマーカーとしての(酸化)変性LDLと、その測定法
LDLは、担送タンパク質であるアポリポ蛋白B(apolipoprotein B: apoB)と、コレステロール、コレステロールエステル、トリグリセリド、リン脂質などの脂質成分からなる分子量約2000kDaの球状粒子である。LDLは酸化的反応により、酸化フォスファチジルコリン、アクロレイン、4-ヒドロキシノネナール、マロンジアルデヒドなどの脂質過酸化物を生じ、これらの脂質過酸化物は、さらにapoBのリジン残基のアミノ基と反応し、修飾する。したがって、酸化LDLとは、様々な酸化脂質、部分的に酸化を受けた蛋白質から成る不均一な集合体である。
1990年代後半から、アルデヒドにより修飾を受けたapoBタンパク質の立体構造を認識するモノクローナル抗体(Holovetらによる)や、酸化LDLに含まれる酸化フォスファチジルコリンを認識するモノクローナル抗体(Witztumら、板部らによる)が作成された。これらの抗体と抗apoB抗体と組み合わせたサンドイッチELISAにより血中酸化LDL値の測定が行われ、ヒト血中に確かに酸化変性を受けたLDLが存在することが示されている。
しかし、抗酸化LDL抗体を用いた測定法には、2つの問題があった。すなわち、(1)抗体では、不均一な粒子である酸化LDLの特定のエピトープの量しか測定できないこと、(2)測定標準品の酸化LDLが、作製するロット間あるいは作製後の時間により性質が変わるため標準品として不充分であることである。
測定法の開発
(1)抗酸化LDL抗体を用いると酸化LDLの特定の構造しか認識しえないという問題に対して、私達は抗体の代わりにLOX-1蛋白を用い、受容体に結合する活性を定量することにより、(酸化)変性LDL量の指標とすることを考案した(Kakutani, M. et al. BBRC 2001)。
なぜなら、種々の変性LDLは受容体に様々な強さ(potency)で結合し、生物学的な反応を細胞に引き起こすが、この際結合が弱いものは多量にあっても弱い反応を引き起こし、結合が強いものは少量で強い反応を引き起こすと考えられるためである。つまり、どれか特定の(酸化)変性LDLの量を測定するよりは、全体をその結合の強さに応じて(活性)測定する方が理にかなっているのではないかということである。
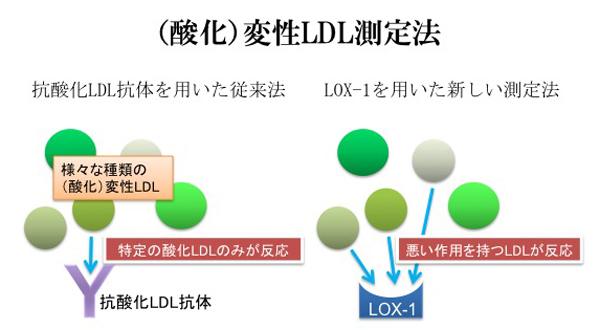
具体的には、LOX-1のリガンド結合領域である細胞外領域の組換えタンパク質をプレートに固相化し、そこに血漿・血清成分中のLOX-1リガンドを結合させ、結合したリポタンパク質を抗apoB抗体で検出するsandwich enzyme immunoassay(EIA)により測定する。この系を用いてin vitroで作製した酸化LDLと未変性LDLをサンプルとして用いたところ、酸化LDLのみが検出され、その酸化の程度に応じ異なる強さで反応することがわかった。
(2)一方、測定標準品の酸化LDLのロット間のバラつきの問題を解決するために、酸化LDLの不安定さの要因になっている脂質を含まない標準品を人工的に作製することを考案した(Iwamoto, S. et al. JAT 2011)。
測定標準品となるための要件は、LOX-1と抗apoB抗体の両方に特異的に結合することであるので、これを人工的な組換蛋白により実現することにした。すなわち、①LOX-1への結合を確保するために抗LOX-1抗体断片を用い、②抗apoB抗体への結合を確保するためにapoBの部分ペプチドを用いることとし、これらの融合蛋白質を発現する融合cDNAベクターを作製した。これを細胞に導入することにより、融合蛋白を調整した。この融合蛋白質は、実際にLOX-1と抗apoB抗体に同時に認識され、(酸化)変性LDL測定のリファレンスとして利用できた。そして、期待通り標準品としての調整品間のバラつきや不安定性は酸化LDLよりも格段に抑えることが可能となった。
以下、私達の方法により測定した、LOX-1に結合するapoB含有リポ蛋白(LOX-1 ligand containg apoB: LAB)を「LOX-1リガンド」と記述する。なぜなら、LOX-1への結合能を得るためのLDLの性質の変化が酸化によるものだけなのか、他の様式の修飾がどれくらい関わっているのか、またLDLではないが、同じくapoBを含有する食餌性のリポ蛋白、カイロミクロン・レムナントについてはどのような分画がLOX-1への結合に関わっているのか、などまだ研究途上であるためである。
動物モデルでの検証
上記のLOX-1リガンド測定法を利用し、LOX-1リガンドの血中レベルと動脈硬化の進展について、まず動物モデルでの評価を行った。まず、高脂血症ウサギ(WHHLウサギ)では正常ウサギ(JWウサギ)と比較してLOX-1リガンドが有意に上昇しており(Kakutani, M. et al. BBRC 2001)、抗酸化能のあるビタミンEや、HMG-CoA還元酵素阻害薬(スタチン)のうち抗酸化能をもつフラバスタチンを投与すると、血中(酸化)変性LDLが低下するとともに、動脈硬化進展が抑制されることが明らかとなった(Oka, K. et al. J Cardiovasc Pharmacol 2006)。
さらに、マウスモデルにおいて検討を行い、高脂肪食を負荷すると、LOX-1に結合する血中のLOX-1リガンドの値は大きく増加し、高脂血症マウスとして知られるapoE欠損マウスでは、正常マウスに比して特にその変化が顕著に見られた(Sato, Y. et al. Atherosclerosis 2008)。そしてapoE欠損マウスで、LOX-1リガンドを特異的に取り除くため、アデノウイルスベクターにより肝臓にLOX-1を異所性発現させると、血中のLOX-1リガンド濃度が低下し、それに伴って動脈硬化の進展が抑制されることが明らかとなった(Ishigaki, Y. et al. Circulation 2008)。
すなわち、血中の高いLOX-1リガンド濃度は、血中の高濃度のLDLコレステロールや動脈硬化の単なる結果として上昇したということにとどまらず、それ自体が原因となって動脈硬化を進展させることが、少なくとも動物モデルでは示唆された。
ヒトでの検証-動脈硬化性疾患の発症リスク評価に役立つか?
そこで、ヒトでも私達が開発したLOX-1リガンド血中濃度測定に意義があるかどうかを検証した。
吹田研究は国立循環器病研究センターが都市部一般市民における心血管病の動態を調査するために20年余り継続して行っているコホート研究である。この研究を利用して、平成6年に吹田住民健診を受診した2437名で前向き研究を行った。平均11年間の脳卒中、心筋梗塞の発症を調査したところ、冠動脈疾患68名、脳卒中91名(うち脳梗塞60名)の発症が観察された。
上述の方法によりLOX-1リガンド濃度を、LOX-1に結合するapoB含有リポ蛋白質として測定すると同時に、可溶型LOX-1(sLOX-1)の測定も行った。なぜなら、可溶型LOX-1の量はLOX-1の発現量を反映していると考えられるため、LOX-1のリガンドと可溶型LOX-1の量を同時に測定することで、血管で実際に起きるLOX-1リガンドとLOX-1の相互作用を推定できると考えられたからである。このLOX-1とリガンドの相互作用を反映すると考えられるパラメーターを『LOX Index = (LOX-1リガンド×sLOX-1)』として算出し、LOX-1リガンド、sLOX-1、LOX Indexの3つのパラメーターの心血管病バイオマーカーとしての有用性を検討した(Inoue, N. et al. Clin Chem 2010)。それぞれの測定値により、四分位に分け、第1四分位を基準にして比例ハザードモデルを利用して相対危険度を求めると、LOX-1リガンドの第4四分位の相対危険度は脳卒中(2.09)、脳梗塞(3.11)、冠動脈疾患(1.82)いずれにおいても最も高く、脳卒中・脳梗塞においては有意な上昇となった。sLOX-1においては有意な変化は認められなかった(1.03~2.13)。更にLOX Indexで評価した場合、脳梗塞の相対危険度は第2~4四分位のいずれも第1四分位と比べて非常に高かった(3.39, 3.15, 3.23)。また、冠動脈疾患の相対危険度もLOX Indexの第4四分位では2.09と有意に上昇していた。
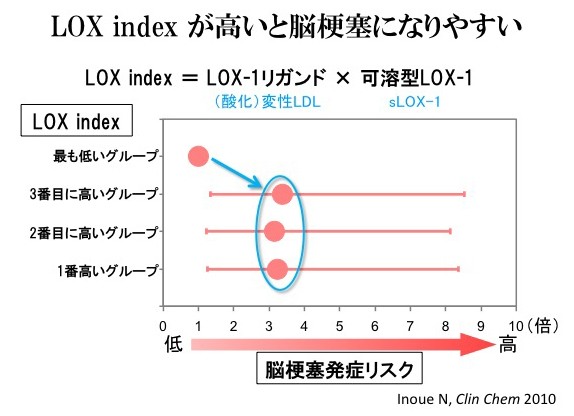
このように、LOX-1リガンドやLOX Index高値は脳梗塞発症の非常に強い危険因子であることが明らかとなった。脳卒中の危険因子としては、高血圧がよく知られているが、高血圧によるリスク上昇の約3倍と同等であることから、LOX-1リガンドやLOX Index高値は高血圧に匹敵する危険因子であるともいえる。またコレステロール値は、少なくともこのコホートでは脳卒中の危険因子としては認められず、脳卒中についてはLOX-1リガンドやLOX Index高値がコレステロールよりも大きな測定意義があることを示している。
酸化LDLの研究は長い歴史があり、私達の測定項目も酸化LDLと関連した指標であるが、これまでに、酸化LDLについての健常者の前向き研究が行われたことはほとんどない。わずかにHolvoetらが、血中酸化LDL値が高いとメタボリックシンドロームになるリスクが高いことを報告しているのみである(Holvoet, P. et al. JAMA 2008)。したがって、疾患の発症リスクについて今回のような検討がされたことはなく、私達が初めて、動脈硬化性疾患について発症リスクの検証を行い、心血管病、特に脳梗塞におけるLOX-1リガンドやLOX Index高値の意義を証明することができた。
治療指標としての可能性
一方、コレステロール低下療法との関係を見るため、スタチン投与の血中LOX-1リガンドへの影響を高脂血症患者で解析した。薬物治療歴のない25名の高脂血症患者へピタバスタチンを6カ月投与し、投与前後でのLOX-1リガンド血中濃度の変化を測定した。その結果、ピタバスタチン投与により血中LDLコレステロール濃度が低下するとともに、LOX-1リガンド血中濃度の有意な低下が観察された(Matsumoto, T. et al. Lipids 2010)。LDLコレステロール濃度低下量とLOX-1リガンド濃度低下量には有意な相関はなく、両者はは同時に起きているものの、LDLコレステロールが減少した結果としてLOX-1リガンドが単に減少しているのではなく、LDL低下作用とは別の機序によりスタチンがLOX-1リガンド量を減少させている可能性が考えられた。治療によるLOX-1リガンド低下の予後への影響は今のところ不明だが、治療効果の指標としての有用性が期待される。また、疾患発症時の診断のための指標としてLOX-1リガンドやsLOX-1が使える可能性も追求していきたい。
今後、私達の測定法が健康診断などに利用されることで、健常時から動脈硬化性疾患発症リスクを評価できるようになり、動脈硬化性疾患の予防に貢献できればと考えている。
参考文献
Holvoet, P. et al. Association between circulating oxidized low-density lipoprotein and incidence of the metabolic syndrome. JAMA, 299:2287-2293, 2008.
Itabe, H. et al. Measurement of Plasma Oxidized Low-Density Lipoprotein and its Clinical Implications. J Atheroscl Thromb, 14:1-11, 2007.
Kakutani, M., Ueda, M., Naruko, T., Masaki, T. and Sawamura, T.: Accumulation of LOX-1 ligand in plasma and atherosclerotic lesions of Watanabe heritable hyperlipidemic rabbits: Identification by a novel enzyme immunoassay. Biochem Biophys Res Commun, 282:180-185, 2001.
Iwamoto, S., Fujita, Y., Kakino, A., Yanagida, K., Matsuda, H., Yoshimoto, R. and Sawamura, T.: An Alternative Protein Standard to Measure Activity of LOX-1 Ligand Containing apoB (LAB) - Utilization of Anti-LOX-1 Single- Chain Antibody Fused to apoB Fragment. J Atheroscler Thromb, 18:818-28, 2011.
Oka, K., Yasuhara, M., Suzumura, K., Tanaka, K. and Sawamura, T.: Antioxidants suppress plasma levels of lectin-like oxidized low-density lipoprotein receptor-ligands and reduce atherosclerosis in watanabe heritable hyperlipidemic rabbits. J Cardiovasc Pharmacol, 48:177-183, 2006.
Sato, Y., Nishimichi, N., Nakano, A., Takikawa, K., Inoue, N., Matsuda, H. and Sawamura, T.: Determination of LOX-1-ligand activity in mouse plasma with a chicken monoclonal antibody for ApoB. Atherosclerosis, 200:303-309, 2008.
Ishigaki, Y., Katagiri, H., Gao, J., Yamada, T., Imai, J., Uno, K., Hasegawa, Y., Kaneko, K., Ogihara, T., Ishihara, H., Sato, Y., Takikawa, K., Nishimichi, N., Matsuda, H., Sawamura, T. and Oka, Y.: Impact of plasma oxidized low-density lipoprotein removal on atherosclerosis. Circulation, 118:75-83, 2008.
Inoue, N., Okamura, T., Kokubo, Y., Fujita, Y., Sato, Y., Nakanishi, M., Yanagida, K., Kakino, A., Iwamoto, S., Watanabe, M., Ogura, S., Otsui, K., Matsuda, H., Uchida, K., Yoshimoto, R. and Sawamura, T.: LOX Index, a novel predictive biochemical marker for coronary heart disease and stroke. Clin Chem, 56:550-8, 2010.
Matsumoto, T., Fujita, M., Sawamura, T., Kakino, A., Sato, Y., Fujita, Y., Matsuda, H., Nakanishi, M., Uchida, K., Nakae, I., Kanda, H., Yoshida, A., Miwa, K., Hayashi, H., Mitsunami, K. and Horie, M.: Pitavastatin reduces lectin-like oxidized low-density lipoprotein receptor-1 ligands in hypercholesterolemic humans. Lipids, 45, 329-35, 2011.
研究概要
酸化LDL受容体LOX-1の発見
LOX-1と細胞との相互作用から細胞接着・炎症へ
LOX-1とCRP
LOX-1に結合する内因性のリポ蛋白質
LOX-1ブロッカーの開発