信州大学医学部 分子病態学教室
LOX-1とCRPHEADLINE
CRPの循環器疾患における意義
CRP (C-reactive protein)は、急性期応答蛋白として古くから知られている。炎症により、血中濃度が健康時の数百倍に上昇するため臨床で炎症マーカーとして頻用されてきた。近年、低濃度でもCRPを高感度で測定できる系ができたことにより、急性炎症時のように大きな濃度上昇はなくても、ごくわずかなCRP濃度上昇が、①将来の虚血性心疾患の発症リスク指標に役立つこと、②急性冠症候群発症の診断指標となることが明らかとなっている。さらに最近、③治療指標としても、その有用性が報告された。すなわち、RidkerらによるJUPITER試験では、LDLコレステロールが正常値であるが、CRP値が2 mg/L以上の値を示す人にスタチンを処方すると、心血管イベントが44%減少すること、そして、スタチンによるLDLコレステロールの減少より予測される効果よりもはるかに大きいイベント減少率が見られたことから、コレステロール低下作用以外のスタチンの効果が加わっていることが示唆されている(Ridker, P.M. et al. New Engl J Med 2008)。このように高感度測定法により得られるCRP血中濃度が虚血性心疾患のマーカーとして非常に有用であることがわかってきた。
CRPはもともと肺炎双球菌 C多糖体結合蛋白として同定され、細菌、補体因子、死細胞、酸化LDLなど様々な分子と結合する機能分子である。上述のようにCRPが虚血性心疾患のマーカーとして非常に有用なことから、単なるマーカーにとどまらず、動脈硬化や虚血性心疾患の進展にCRPが積極的にかかわっているのではないかという視点での研究が進んできた。特に血管内皮細胞への作用が注目されており、CRPにより血管内皮細胞で活性酸素種産生、ケモカインや細胞接着分子の発現誘導、NO産生減少などの、proatherogenicな変化が起こるとされている。これらの反応の多くはFcγ受容体であるCD64、CD32、CD16を介した反応であると言われている。
これらの血管機能と関連したCRPの生理活性については相反する論説や結果もあった。論争の一因は、純度の低いCRPが用いられたことによる再現性の低い実験報告にあるが、これらの生理作用を否定する急先鋒であったPepysら自身も、ラットの心筋梗塞モデルでCRP投与が心筋梗塞の重症化をまねき、投与したCRPは心臓組織内で補体系の活性化を誘導していることを示している(Pepys, M.B. et al. J Exp Med 1999)。さらに、PepysらはCRPに結合しCRPの補体系活性化をブロックする低分子化合物を設計し、その投与により、同じラットモデルでCRPによる心筋梗塞悪化をこの低分子化合物が抑制することを示した(Pepys, M.B. et al. Nature 2006)。また、CRPの生理作用を担う受容体として報告されてきたFcγ受容体の1つFcγRIIa受容体とCRPのファミリーであるSAPとの複合体の結晶構造も明らかとなり(Lu, J. et al. Nature 2008)、CRPの生理作用についての議論も整理されてきたと考えられる。
そこで、私達は血管内皮機能障害にともに関与するLOX-1とCRPが何らかの形で相互作用することにより、血管機能に影響を与える可能性がないかを検討した。
CRPは血管内皮でのLOX-1発現を誘導する
CRPでヒト大動脈培養血管内皮細胞をCRPで処置すると、LOX-1の発現は24時間後まで増加し、CRP濃度が25 mg/Lまで、濃度依存的な誘導がみられた(Li, L et al. Circ Res 2004)。このCRPによるLOX-1の発現誘導はCRP受容体として知られるFcγ受容体のCD64およびCD32の抗体で処置することにより抑制されることから、これらの受容体を介していると考えられた。CRPはIL-6の発現も誘導し、一方でIL-6はLOX-1の発現を誘導する。そこで、CRPによるLOX-1誘導がIL-6を介している可能性を考え、抗IL-6抗体で処置すると、CRPによるLOX-1発現誘導は抑制された。また、抗エンドセリン-1抗体処置によっても抑制されることから、エンドセリン分泌もLOX-1発現誘導に関わっていると考えられる。
CRPで処置した内皮細胞は単球の接着性が亢進し、これはVCAM-1やICAM-1の抗体により抑制されず、抗LOX-1抗体により抑制されることから、主に上述のLOX-1発現亢進に依存した現象と考えられた。同様に、CRP処置した内皮細胞はLOX-1に依存した標識酸化LDLの取り込みが亢進していた。
これらのことから、CRPによる内皮細胞機能変化は、LOX-1の発現誘導と密接な関係があることが示唆された。
CRPはLOX-1に結合する
次に、LOX-1とCRPが直接相互作用する可能性を検討した。蛍光標識したCRPをLOX-1発現細胞株に作用させるとLOX-1の発現量に依存した結合が観察された(Fujita, Y. et al. Clin Chem 2009)。そして、培養血管内皮細胞に対するCRPの結合が、LOX-1に対するsiRNA処理により一部抑制されることも明らかとなった。また、無細胞の系で組換LOX-1蛋白を固相化したプレートに非標識CRPが結合したことから、細胞で観察された現象が、LOX-1によっておこる間接的な現象ではなく、CRPとLOX-1が直接結合することによると言える。
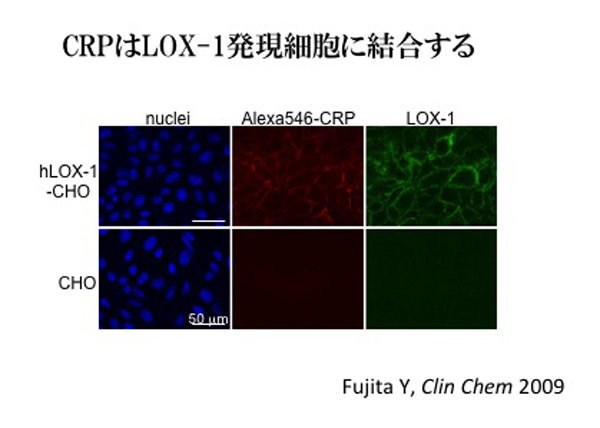
上述のように、CRPの受容体としてFcγ受容体が広く認知されているので、CRPの結合をFcγ受容体とLOX-1で比較した。LOX-1では1-3 mg/LのCRP濃度から結合が観察されたのに対し、Fcγ受容体ではより高い濃度で結合が観察された。Fcγ受容体は、炎症細胞に強く発現するため、炎症時に比較的高濃度となるCRPが白血球で作用するときに機能するのに都合がよい。一方LOX-1は、Fcγ受容体の発現が比較的低く、血液中にあるIgGがCRPと競合するのでFcγ受容体へは作用しにくい内皮細胞のような細胞で、CRPの作用を媒介するのに都合がよいと解釈することができる。疫学研究ではCRPの心血管病発症リスク評価におけるcut-off値は1-3 mg/Lに通常設定されるので、このレベルのCRPでLOX-1への結合がみられることは、心血管病発症リスクに対する影響を左右する可能性も示唆する。
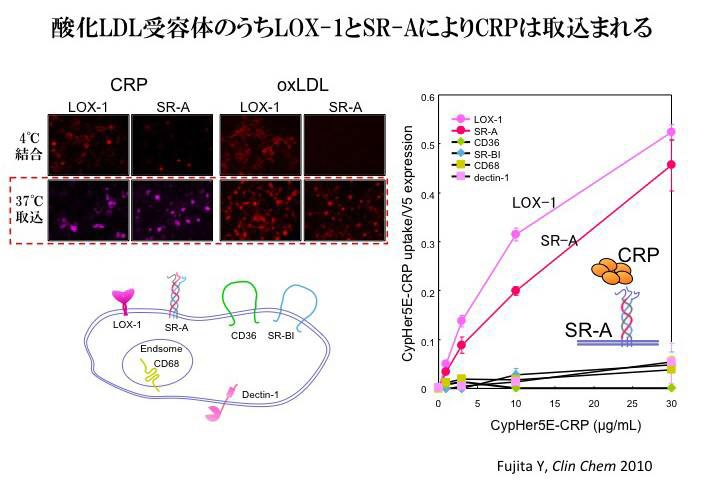
LOX-1以外の酸化LDL受容体へのCRPの作用を検討してみると、結合ではLOX-1だけが強くCRPを結合するのに対し、取り込みではLOX-1だけでなくSR-Aでも蛍光標識CRPが観察された。他のCD36、SR-BI、CD68、dectin-1を発現させたCOS-7細胞では蛍光標識CRPの取り込みはみられなかった(Fujita, Y. et al. Clin Chem 2010)。
SR-Aは、マクロファージで機能するので、THP-1細胞をマクロファージに分化させ、蛍光標識CRPの取り込み実験を行った。するとマクロファージに分化させたTHP-1細胞内への、蛍光標識CRPの取り込みは、SR-Aに対するsiRNA処理により抑制されることが明らかとなった。マクロファージでのSR-Aを介したCRPの機能は不明だが、病原体を結合したCRPを貪食することにより生体防御に働いているのかもしれない。
CRPはLOX-1に依存して補体活性化を起こす
CRPがLOX-1と結合することの生理的意義を検証するために、CRPが生体内で起こす反応についての解析を行った。高血圧ラットのSHRSPはLOX-1発現が極めて高いことから、SHRSPと正常血圧ラットでLOX-1発現も少ないWKYを比較して実験を行った。CRPを皮内注射し、静注したエバンスブルーの漏出により血管透過性の評価を行うと、SHRSPではWKYと比較し有意に強いCRPによる血管透過性の亢進がみられた。この際、VEGFによって起こる血管透過性亢進には違いは見られなかった。このCRPによりSHRSPで惹起される血管透過性亢進は抗LOX-1抗体を同時投与にすることにより抑制され、LOX-1とCRPの相互作用によるものであることが示唆された。さらに、SHRSPのCRP注射部位の皮膚組織を観察してみると、補体系活性化、白血球の浸潤が見られ、それらは抗LOX-1抗体を同時投与した場合には有意に抑制されていた(Fujita, Y. et al. Clin Chem 2011)。
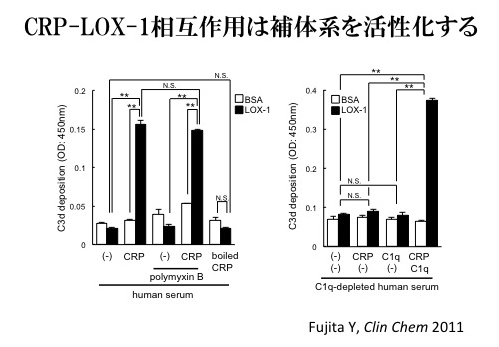
そこでin vitroの実験を行い、LOX-1蛋白を固相化したプレートにCRPと血清を作用させると補体系活性化が起こること、さらに、これがC1qに依存する補体系古典経路の活性化によることを明らかにした。これらのことからin vivoでのCRPによる補体系活性化はLOX-1により促進されたと考えられた。また、CRPの機能的構造はC1qが結合するA faceとフォスフォコリンが結合するB faceからなるが、LOX-1とCRPの結合がフォスフォコリンの添加により抑制されることから、LOX-1とCRPのB faceが結合し、反対側のA faceでC1qを介した補体活性化を引き起こしていると考えられた。
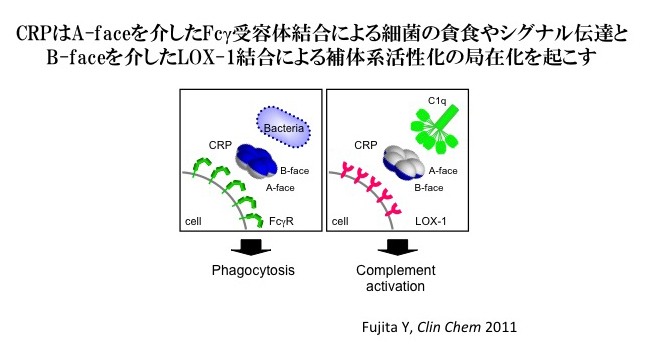
CRPによる血管内皮の反応がLOX-1により引き起こされる変化とよく似ているため、私達はCRPとLOX-1の関係に着目した。CRPは内皮細胞でLOX-1の発現誘導を引き起こし、LOX-1による単球接着や酸化LDL結合を促進する。一方で、LOX-1はCRPを結合して、CRPによる補体系活性化を促進するとともにLOX-1の発現部位に局所化すると考えられる。
このように虚血性心疾患の危険因子、酸化LDLの受容体であるLOX-1が、独立した危険因子であるCRPの受容体としても働き、CRPと協調して血管透過性亢進や補体系活性化を引き起こすことが明らかとなった。
参考文献
Ridker, P.M. et al.: Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med 359:2195-2207, 2008.
Pepys, M.B. et al.: C-reactive protein and complement are important mediators of tissue damage in acute myocardial infarction. J Exp Med 190:1733-1740, 1999
Pepys, M.B. et al.: Targeting C-reactive protein for the treatment of cardiovascular disease. Nature 440:1217-1221, 2006.
Lu, J. et al.: Structural recognition and functional activation of FcγR by innate pentraxins. Nature 456, 989-992, 2008.
Li, L., Roumeliotis, N., Sawamura, T. and Renier, G.: C-reactive protein enhances LOX-1 expression in human aortic endothelial cells: relevance of LOX-1 to C-reactive protein-induced endothelial dysfunction. Circ Res 95:877-883, 2004.
Fujita, Y., Kakino, A., Nishimichi, N., Yamaguchi, S., Sato, Y., Machida, S., Cominacini, L., Delneste, Y., Matsuda, H. and Sawamura, T.: Oxidized LDL receptor LOX-1 binds to C-reactive protein and mediates its vascular effects. Clin Chem 55:285-294, 2009.
Fujita, Y., Kakino, A., Harada-Shiba, M., Sato, Y., Otsui, K., Yoshimoto, R. and Sawamura, T.: C-reactive protein uptake by macrophage cell line via class-A scavenger receptor. Clin Chem 56:478-481, 2010.
Fujita, Y., Yamaguchi, S., Kakino, A., Iwamoto, S., Yoshimoto, R. and Sawamura, T.: Lectin-like oxidized LDL receptor 1 is involved in CRP-mediated complement activation. Clin Chem 57:1398-1405, 2011.
研究概要
酸化LDL受容体LOX-1の発見
LOX-1と細胞との相互作用から細胞接着・炎症へ
LOX-1に結合する内因性のリポ蛋白質
LOX-1ブロッカーの開発
LOX-1を用いた診断技術の開発