�@�@�@�M�B��w��w���@���q�a�Ԋw�����@�@�@�@�@
�_��LDL��e��LOX-1�̔���HEADLINE
�u�����l��艓�������ʂ���Ƃ�����C����͎������l�����̌��̏�ɗ����Ă��邩�炾�B�v (If I have seen a little further, it is by standing on the shoulders of Giants.)�Ƃ���Newton�̌��t��҂܂ł��Ȃ��A�ЂƂЂƂ̗D�ꂽ�������ʂ���l���瑱���A�ȂƂ�������̒��Ő������Ă���B���͖S���Ȃ�ꂽ���钘���ȕ��q�����w�̐搶�������̎d�����w���āA���̂悤�Ȏd����100�N�O����̕����w�̐i���Ɏn�܂�A����ɑ������w�A�����w�̔��W�Ƃ�����Ղ̏�ɗ����Ă���̂ł���Ɛ����ꂽ�B�����āA������w���̊w���ł��������������邾�낤���A���ꂩ��͈�w�����W����Ԃ��ƌ����Ċ�b��w�̓��ւƗU��ꂽ�B�����w�Ɍ��炸��������͂��܂�ɂ��L���A���������ǂ̂悤�ȕ����Ɍ������ē��ݏo���ׂ����l�������˂Ă������ɂ��̂悤�Ȍ��t�͑傫�ȉe����^���A���̌����̊�{�I�ȃX�^���X�́A�a�C�̗����ɂȂ���A�ł���ΐf�f�E���ÂɌ��т���b�I�Ȍ���������Ƃ����`���Ƃ邱�ƂɂȂ����B
�����ł͌��Nj@�\�̒��߂Ɣj�]�ɏd�v�ł���\���̂���_��LDL��e�́Alectin-like oxidized LDL receptor-1(LOX-1)�̔����ɂ��ċL�ڂ��邪�A�����ɂ����錳�ƂȂ������l�����̎d���ɂ��čŏ��ɐG��˂Ȃ�Ȃ��B
�R���X�e���[����ӕa�Ƃ��Ă̓����d��
���t���̃R���X�e���[�����������Ƃ������d���̐i�s�𑣐i���A�������S�����̔��ǂ̏d�v�ȃ��X�N�t�@�N�^�[�ł��邱�Ƃ��u�w�������疾�炩�ɂ���Ă���������āALDL�R���X�e���[�������ʃR���X�e���[���ƌĂꂻ�̑�Ӓ��߂����ƂȂ�Ɠ����ɁA�Ƒ������R���X�e���[�����ǂ̊��҂��m���ɋ������S�����ǂ��₷���A�P������`�q�ُ̈�ɂ�肱�̂悤�ȏ������炳��邱�Ƃ����������悤�ɂȂ��Ă����B
����Goldstein��Brown�ɂ��LDL��e�̂̔����Ƃ��̌����ɂ�鍂�����ǔ��ǂ̉𖾁A�R���X�e���[�����������y�f�ł���HMG-CoA synthase��HMG-CoA reductase�̓]�ʒ��߈��q�ł���sterol regulatory element binding protein�̓���A����ɂ��̊��������q�ł���A�ؒf�y�f�̓���Ƃ�������A�̎d���ɂ��R���X�e���[����ӂ̑����̕��������炩�ɂ���Ă���(Brown, M.S. and Goldstein, J. L Science 1986, Goldstein, J.L. and Brown, M.S. Nature 1990)�B���̂悤�Ȑ����w�I�Ȏd���ƕ��s���āA�����͔��m�ɂ�锭����[���Ƃ���AHMG-CoA reductase�j�Q�A�X�^�`���ƌĂ��R���X�e���[���ቺ��Ƃ��ėՏ��̏�ōL���g���A����ɋ������S�����̔��Ǥ���S���̒ቺ�Ɋ�^���邱�Ƃ����炩�ɂ���Ă����
���̂悤�ɃR���X�e���[����ӂƓ����d���Ƃ̊֘A�͊m�����ꂽ���̂̂悤�Ɏv����B�������A�R���X�e���[�����̂͐��̓��̗l�X�̃z��������\�������̂��ƂƂ��ĕK�{�̕����ł���A�����R���X�e���[���Z�x�������̂͂����Ȃ��Ƃ͂����A����ȏ�Ԃł����Ȃ葽�ʂɑ��݂���B���������āA�R���X�e���[�����瓮���d����������悤�Ƃ���ɂ͂��̊Ԃɂ����������ٓI�ɓ����d���̔����������N�����@�������݂���ƍl����ق����s�����悢�B
Beyond cholesterol
�ł͎��̈��͉����H����ɓ�����悤�ɁA�܂��ɁgBeyond Cholesterol�h�Ƒ肵��UCSD��Steinberg���1989�N�ɑ����\����(Steinberg, D. et al., New Engl J Med, 1989)�B����Milestone�I�_���́ALDL�̏C���������d���̑��i���q�Ƃ��ďd�v�ł͂Ȃ����Ƃ����ނ�̂����������ڂƂ�����x�������A�̎d�����܂Ƃ߂����̂ł���B������LDL�̏C���̒��ł��A���Ɏ_���I�C�������̂悤�ȓ_���璍�ڂ��ꂽ�B���Ȃ킿�A�@�R�_�������������d���̐i�W�ɗ}���I�ł���Ƃ����u�w��������ʂ̑��݁A�A���ۂɐl�H�I�Ɏ_������LDL��Ɖu���čR�̂��쐻���A�Ɖu�g�D���F���s���Ɠ����d���������F����邱�ƁB�܂��A�����d�������璊�o�����LDL�ɂ͐l�H�I�Ɏ_������LDL�Ǝ����ω��������Ă��邱�ƁB�BLDL���̂��̂������̂悤�ȕϐ�����LDL�������d�����œ����I�Ɍ�����}�N���t�@�[�W�̖A�����������N�������ƁA�ł���B
�����A���̓��łǂ̂悤�Ɏ_��LDL���Y������A�ǂ̂悤�Ȏ_���C���������̂����ۂ̊�����S���Ă���̂��͍ŋߏ����������̂̂܂��[���ɂ킩���Ă��Ȃ���������A���Ȃ��Ƃ��l�H�I�Ɏ����Ǔ��Ŏ_������LDL�����܂��܂Ȑ��������������Ƃ͖��炩�ƂȂ��Ă��顂��̂悤�Ȏ_��LDL�͎_��LDL����ٓI�ɔF�������e�̂���čזE�ɍ�p����ƍl������B�����ă}�N���t�@�[�W�̖A���זE�ւ̕ω��Ɋ֘A�����_��LDL��e�̂Ƃ��ẮASR-A�ACD36�Amacrosialin�Ȃǂ̕��q�����肳��Ă���
Endothelial dysfunction
����A�����ʂ̗��ꂩ��Ross�͍זE�����w�I���_����������������A�h���ɑ���זE�̔����Ƃ����`�œ����d���𑨂��悤�Ƃ����B�ނ͍ŏ����Ǖǂ̕����I�ȏ��Q�����������ƂȂ�A���Q���ʂɐڒ����������������̑��B��U������ƍl���APDGF�̑��݂������Ȃǂ̐��ʂ��������B�������A�����d�����̌��Ǔ������K�����������Ă��Ȃ����ƁA���Q�̌����ƂȂ�͂��̂��艞�͂̂ނ���ア���ʂɓ����d�����͔��B���₷�����ƁA�����ē����d�����ɂ͌��t������P���𒆐S�Ƃ����������������N�����Ă��Ă���A����ɂ͔�������a�����ʂɌĂъ�悤�ȕω����ŏ��ɓ���זE�ɋN���Ă���悤�ł��邱�Ƃ��킩���Ă����B�����ŁARoss�͓���זE�̋@�\�I�ȕω��������d���̈������ƂȂ��Ă���̂ł͂Ȃ����Ƃ̒�Ă��s���A���̓���זE�̋@�\�ω����hendothelial dysfunction�h�Ƃ������t�ł���킵��(Ross, R. Nature 1993)�B
���̔w�i�ɂ́A���Ǔ������\������킸����w�̌��Ǔ���זE�����ǑS�̂̋@�\�߂��Ă���d�v�ȍזE�ł��邱�Ƃ��A���X�̐������������̔�����זE�ԑ��ݍ�p���i��ڒ����q�̔����Ȃǂɂ��A���Ȃ薾�炩�ɂȂ��Ă������Ƃ�����B���͂Ȍ��ǎ��k�����ł���G���h�Z������o�ɕ����ł����_�����f(NO)�����̑�\�ł���B�唼�̌��ǒo�ɕ����̂͂��炫������זE������o�����NO�ɏW��邱�Ƃ���A����זE��NO���o�͌��ǂ̍P�퐫��ۂ�œ��ɏd�v�ȗv�f�ł���(Furchgott, R.F. and Zawadzki, J.V. Nature 1990)�B�������ANO�͓����d���̉ߒ��ŋN���镽���̑��B�A�������̐ڒ��A�����̋ÏW�ɑ��A���ׂė}���I�ɂ͂��炭�B�����āA���������R���ǃ��b�g�⍂�����ǃE�T�M�A���A�a���b�g�Ȃǂ̕a�ԃ��f��������q�g�̂��̂悤�Ȏ������҂̌��ǂł́A���Ǔ��炩���NO���o���������Ă���B���̂悤�ȓ����A���҂̌��ǂ������d�����N�����₷���Ƃ������Ƃ͎��m�̎����ł���B
�V�������肳��Ă�������זE�̋@�\���q�̕a�Ԃɂ����铮�Ԃ̉�͂ɂ��A�_��LDL������זE�̋@�\�ω��������N�����Ƃ����_�ł��d�v�Ȉ��q�ł��邱�Ƃ��킩���Ă����B���Ȃ킿�A���ǂ̓���ˑ����̒o�ɁA�܂茌�Ǔ��炩���NO�̕��o���_��LDL�ŏ������邱�Ƃɂ��ቺ���邱�ƁA�����Ă���͐����LDL�ł͋N���Ȃ����Ƃ������ꂽ�B����ɁA�_��LDL�͔������������q�┒�����ڒ����q�A�זE���B���q�̌��Ǔ���זE�ł̔�����U�����A���ǂ̎��k�o�ɂ̂悤�ȋ@�\�ɑ����p�����łȂ��A���ǂ̌`�ԓI�ȕω��̒��ڂ̗v���ƂȂ錌�Ǖǂւ̔������̐N���⌌�Ǔ����w�ł̕����ؑ��B�ɑ��Ă��d�v�Ȗ������ʂ������邱�Ƃ��킩���Ă���������Ɏ����āA�R���X�e���[����ӂ���̌����Ɠ���זE�@�\���猌�Ǖa���l���錤������ɍ������邱�ƂɂȂ����B
LOX-1�̔���
�ł́A�_��LDL�̓���זE�ւ̍�p��}����e�̂͂ǂ̂悤�ȕ��q�ł��낤���B���̓������o�����߂ɁA���B�̌������ł͓���זE�ɔ�������_��LDL��e�̂̃N���[�j���O�����݁A1997�N�A��e�̂̍\���𖾂炩�ɂ��邱�Ƃ��ł���(Sawamura, T. et al. Nature 1997)�B�_��LDL�̌����\���w�W�ɂ��������N���[�j���O�ɂ���āA�E�V�哮������זE��蓾��ꂽLOX-1��cDNA�́A810bp��open reading frame�������A���q��30,872�̒`�����R�[�h���Ă����B���ۂɂ́A�����t���ɂ�蕪�q�ʖ�5���ɑ��債���`�����������Ă���B�S�̍\���́AN���[���זE�����AC���[���זE�O�ɏo��זE�����ђʌ^�̂�����II�^���`���ł���BN���[�����זE���h���C���A�����߃h���C���A�l�b�N�h���C���A���N�`���l�h���C����4�̃h���C���ɕ�������B
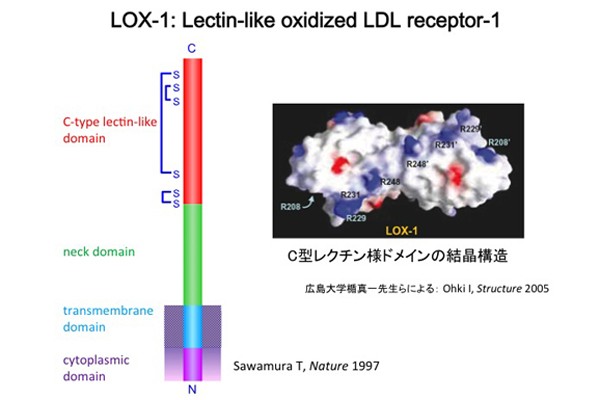
���̂����A���N�`���l�h���C�����_��LDL�F�����ʂł��邱�Ƃ������ψّ̂̉�͂ɂ�薾�炩�ɂȂ��Ă���B���N�`���l�h���C����C�^���N�`���t�@�~���[�̓����F�����ʂƃz�����W�[�������A�����̒`���ł悭�ۑ�����Ă���6�̃V�X�e�C���c��̈ʒu�͊��S�ɕۂ���Ă���B�q�gLOX-1�́A���N�`���l�h���C���̍����ɃV�X�e�C���c�1�]���ɂ���A���ꂪ���q��S-S�����Ɋ�^���邱�Ƃɂ��A�z��2�ʑ̂Ƃ��ċ@�\���Ă���B�L����w�̏|�^��搶�̌����O���[�v��LOX-1�̍זE�O�h���C���̌������ɐ�������A���N�`���l�h���C����2�ʑ̍\���̕\�ʂɃA���M�j���c��K���������z�Ă��邱�ƂƁA�����̉���A�~�m�_�c����K���h�����ɏd�v�ł��邱�Ƃ�������Ă���B�l�b�N�h���C���ɂ́A�v���e�A�[�[�ؒf���̍������ʂ�����A�����Őؒf���ꂽLOX-1�����o����A���t���ɑ��݂��邱�Ƃ��m���Ă���B�זE���h���C���̓A�~�m�_��30����Ȃ�Z�����߁ALOX-1�������̃V�O�i���͑��̕��q�Ƃ̉�ɂ��`�B�����\��������B
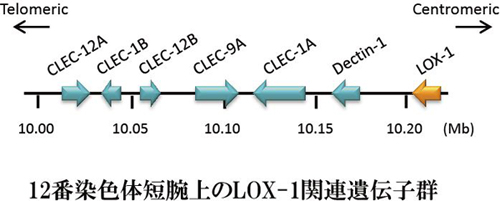
�q�gLOX-1��`�q��12�Ԑ��F�̒Z�r12.3-13.2�Ɉʒu���A6�̃G�N�\������\������Ă���B�G�N�\��1�A2�A3������LOX-1�̍זE���h���C���A���ђʃh���C���A�l�b�N�h���C���A�G�N�\��4�A5�A6��3�����N�`���l�h���C���ɑΉ����A�@�\�I�h���C���ƃG�N�\�������ꂢ�ȑΉ����݂��Ă���BLOX-1��`�q���ʒu������F�̗̈�ɂ́A�݂��Ƀz�����W�[������C�^���N�`���l��e�̈�`�q���N���X�^�[���Ȃ��Ă���B�������A�_��LDL��F������̂͂����̒���LOX-1�݂̂ł������B
LOX-1�ƍł������z�����W�[������dectin-1�́A�O���J����F�����A���ɐ^�ۂɑ��鐶�̖h���`�q�Ƃ��ċ@�\���邱�Ƃ����炩�ɂȂ��Ă��Ă��蒍�ڂ���Ă���B���LOX-1���o�N�e���A��F�������ÐH����@�\�������Ƃ����炩�ɂȂ��Ă���B�����[�����ƂɁA��ᇍזE��F������NK cell receptors��`�q��LOX-1�Ǝア�z�����W�[�������A���̐��F�̗̈�ɃN���X�^�[������Ă���B���Ȃ킿�A�������̂悤�ȊO�G��F�������`�q�ƁA��ᇍזE�̂悤�ȓ����琶�����ٕ���F�������e�̂��A�����\���������������F�̗̈�ɑ��݂��Ă��邱�Ƃ́A����N�����炻�ꂼ��ɓ��ِ�������`�q�Ƃ��Đi���̉ߒ��Ŕ��B���Ă����Ƒz�������B
�܂��ALOX-1�ƃz�����W�[������`�q�Q�����łȂ��A���̎_��LDL�Ɍ�������`���̂��������A���ǁE���̖h�䔽���ɂ�����镪�q�̂悤�ł���B�t�ɍl����A�{�����ǁE���̖h�䔽���œ������q���{�����̓��ɂقƂ�Ǒ��݂��Ȃ��͂��̎_��LDL���ٕ��Ƃ��ĔF�����邽�߂ɁA�O�G�ɑ��ċN�����͂��̔�����������̕����ɑ��ċN�������ƂɂȂ�A���Ǖǂ̖����I�ȉ��ǂ���N�����̂�������Ȃ��BRoss�͔ӔN�A�����d���͉��ǔ������̂��̂ł���Ƃ̘_�����c���Ă�������(Ross, R. New Engl J Med 1999)�A�����d���͉��������ł͖��ɂȂ�Ȃ��������ȔȂ̔F�����A�q�g�̓���ȐH�K���Ƒ�ӂ̌��ŗh�炢�ł��܂������Ƃɂ��a�C�Ƃ�����̂�������Ȃ��B
�Q�l�_��
- Brown, M. S. and Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science 232: 34-47, 1986.�@�m�[�x����܍u��
- Goldstein, J. L. and Brown, M. S. Regulation of the mevalonate pathway. Nature 343, 425-430, 1990.
- Steinberg, D. et al. Beyond cholesterol: modifications of low density lipoprotein that increase its atherogenicity. N Engl J Med 320, 915-924, 1989.
- Ross, R. The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature 362, 801-809, 1993.
- Furchgott, R.F. and Zawadzki, J.V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature 288, 373 ? 376, 1980.�@�m�[�x����ܘ_��
- Sawamura, T., Kume, N., Aoyama, T., Moriwaki, H., Hoshikawa, H., Aiba, Y., Tanaka, T., Miwa, S., Katsura, Y., Kita, T. and Masaki, T. An endothelial receptor for oxidized low-density lipoprotein. Nature 386, 73-77, 1997.
- Ross, R. Atherosclerosis: an inflammatory disease. N Engl J Med 340, 115-126, 1999.
- *�B��@���Ǔ���זE�ɔ�������_��LDL��e��LOX-1�@�����w�@74:365-376, 2002.�����ς��Ĉ��p���Ă��܂��B
�����T�v
LOX-1�ƍזE�Ƃ̑��ݍ�p����זE�ڒ��E���ǂ�
LOX-1��CRP
LOX-1�Ɍ�������������̃��|�`����
LOX-1�u���b�J�[�̊J��
LOX-1��p�����f�f�Z�p�̊J��