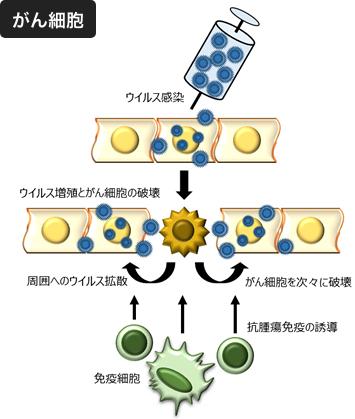
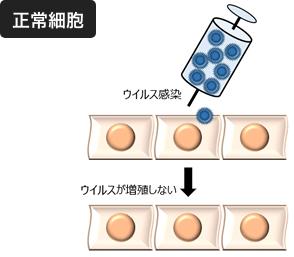
悪性黒色腫(皮膚がん)の
新たな治療法開発に
ご協力いただける方を
募集しています。
患者ご本人様、ご家族、医療従事者の方、
「詳しい説明を聞きたい」「治験に参加してみたい」という方、
お気軽にお問い合わせください。
信州大学医学部附属病院臨床研究支援センター 0263-37-3389 東京大学医科学研究所附属病院TR・治験センター 03-5449-5462 お問い合わせフォーム